“文献精读系列”是脊柱脊髓损伤再生修复教育部重点实验室举办的常规科研交流学习会议,旨在聚焦领域内前沿进展,探究学术尖端技术研究路线,培养锻炼青年科研人员与硕博生科研思维。
【文献精读】会议日期:2023年12月5日 审校人/共同撰稿人:林古法 朱颜菁 报告人/撰稿人:郑鑫鑫 编辑:宋思敏
小胶质细胞是特化的巨噬细胞,在中枢神经系统特别是大脑发育、内稳态和疾病中起着至关重要的作用。小胶质细胞由来自卵黄囊的红髓系祖细胞(erythromyeloid progenitors,EMPs)发育而来,推测在人类妊娠4.5到5.5周之间进入大脑。越来越多的证据表明,小胶质细胞可能与多种脑部疾病有关,包括自闭症谱系障碍(autism spectrum disorder,ASD)等神经发育疾病。因此,需要研究小胶质细胞在健康与疾病当中的作用及机制。然而,到目前为止,模拟人类大脑环境和小胶质细胞之间相互作用的能力受到严重的阻碍。这种阻碍来自于模拟细胞所处环境的复杂性。先前的许多研究工作证明大脑环境有助于维持和协调小胶质细胞的特性。因此要了解和研究人类小胶质细胞的功能,需要功能成熟的细胞在复杂的大脑环境中运行。
早前研究中,已从人类多能干细胞(human pluripotent stem cells,hPSC)诱导形成小胶质细胞且可以将纳入脑类器官进行短期培养,但这些体外结构在多大程度上支持小胶质细胞成熟和长期存活,以及整合后的细胞最终是否能获得与其体内对应细胞完全相似的状态,仍是未知数。

2023年5月11日,美国索尔克生物研究所遗传学实验室的Gage教授团队在Cell杂志上发表了题为“An in vivo neuroimmune organoid model to study human microglia phenotypes”的研究论文,报导了一种在体神经免疫类器官模型,该模型允许在体内生理条件下在血管化的人脑类器官(human brain organoid,iHBO)中研究hPSC衍生的人小胶质细胞(human microglia,hMGs)。
该项工作首先利用共培养的方法在体外制备了含有EMPs(带有tdT标记)成分的前脑类器官,发现前脑类器官诱导的第35天至第42天之间最适合EMPs定植显。共培养的EMPs表达造血系统的标志物CD43,且特异性地填充前脑类器官的边缘皮质板样区域,而不填充脑室样区域,且超过96%的整合tdT阳性细胞表达髓特异性谱系决定转录因子PU.1。但是,在缺乏CSF-1、TGFb和IL-34的情况下,整合的EMPs无法在这些结构中长期存活(图1)。而补充CSF-1、TGFb和IL-34细胞因子则允许EMPs进一步的体外分化,整合细胞的后代具有基本的分支样形态。与在单层条件下生长的hPSC衍生的小胶质样细胞相比,类器官定植的EMPs衍生细胞更多地处于初级分叉样状态,并在整合后6周表达了髓系标记物IBA1,但在体外未检测到稳态小胶质细胞的特征标记物,如TMEM119或P2RY12。
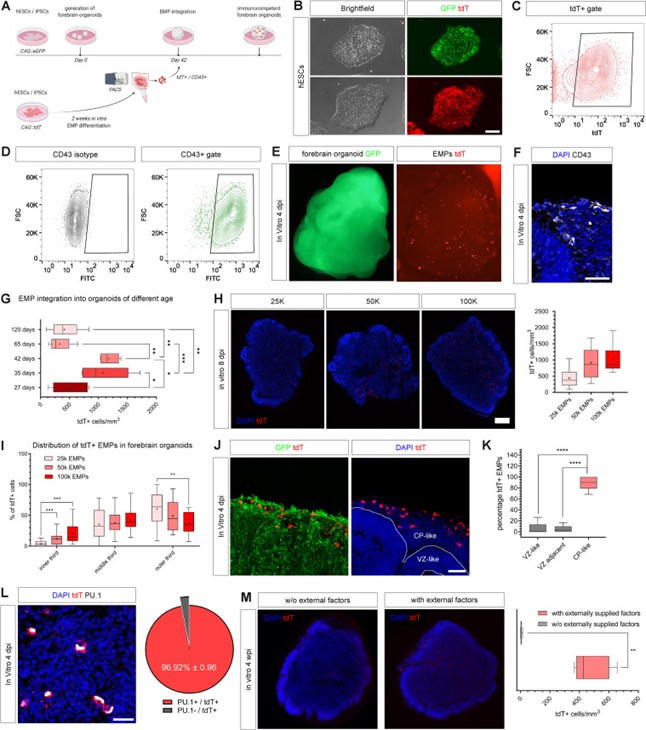
图1 通过红髓系祖细胞(EMPs)进行前脑类器官定植的优化
为了进一步评估这些细胞的转录组谱,研究者对EMPs整合后6周分离的来自3个独立类器官批次的4422个tdT阳性细胞进行了单细胞RNA测序,发现与神经元和其他脑细胞类型相比,该细胞与人类胎儿小胶质细胞具有更高的相似性。这些细胞中大多数表达髓系标记物AIF1(编码IBA1),却几乎完全不表达成熟的小胶质细胞特异性基因P2RY12,且未检测到TMEM119和SALL1转录本。这表明要么是小胶质细胞对环境特异性特征的获得不足,要么是向成熟的稳态状态的过渡尚不完全(图2)。
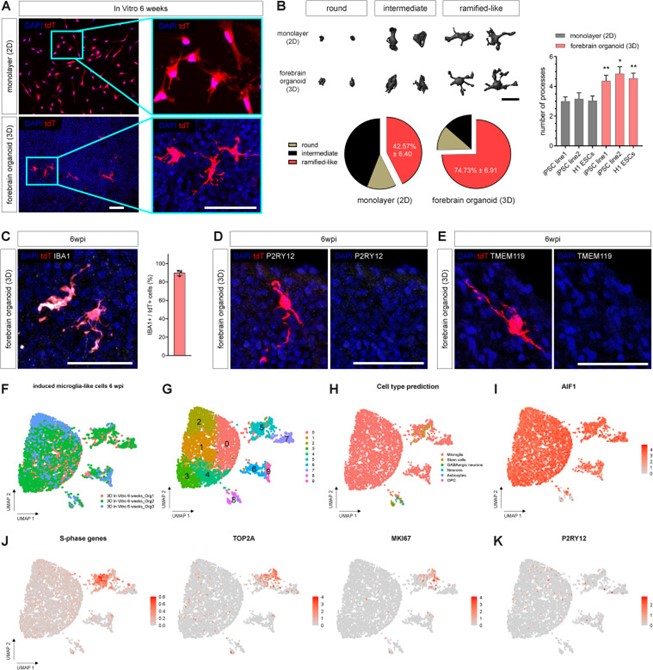
图2 源自EMP的小胶质细胞的体外表征
接下来,研究团队延长了体外分化的时间,以评估随着时间的推移类器官环境是否允许出现成熟的稳态小胶质细胞状态。从细胞整合后的2周到13周,tdT阳性细胞逐渐丢失。tdT阳性颗粒碎片逐渐出现在类器官的中心,而只有少数tdT阳性细胞位于类器官的套层域,说明大脑类器官核心发生了进行性坏死。存活的小胶质细胞大多数呈圆形、激活的形态,不表达TMEM119或P2RY12,表明持续的细胞激活和不利的环境阻碍了长期的体外共培养(图3)。
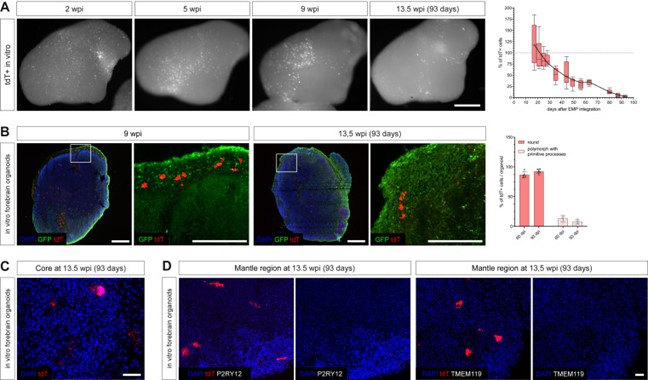
图3 体外长期共培养的表征
为了克服这些不利因素并在更符合生理条件下模拟大脑环境,作者在体外EMP整合10天后,将含有EMP的皮质类器官移植到免疫缺陷的NOD/SCID小鼠的压后皮质(retro-splenial cortex),以使其有效血管化。移植含有EMP的类器官可以使tdT阳性细胞存活下来,并只填充人类的类器官组织,而不向宿主小鼠大脑的迁移。值得注意的是,宿主小鼠的CSF-1没有人源化,这表明血管化的人类移植物足以支持hMG在其边界内持续存活(图4)。
几乎所有的tdT阳性细胞在移植后8周均显示出IBA1的高表达,此外,移植物中的tdT阳性细胞共表达髓系转录因子PU.1以及人特异性的标志物TMEM119。重要的是,tdT阳性细胞显示出特征性的成熟小胶质细胞形态,99%以上的tdT阳性细胞呈分枝状。形态计量分析表明,小胶质细胞具有高度复杂的分支模式,其中有大量的高阶过程,这与已报道的人类和小鼠脑切片中的小胶质细胞相似(图4)。
来自3个独立的iPSC系的iHBO模型移植均显示hMG有特征性的小胶质细胞形态和IBA1的高表达。将iHBO驻留的hMG与人脑组织中的IBA1阳性小胶质细胞进行比较,发现两者具有相似的形态外观。综上所述,该嵌合平台为hMG存活和成熟为脑驻留免疫细胞提供了有利环境,这些细胞与原位hMG的形态高度相似(图4)。
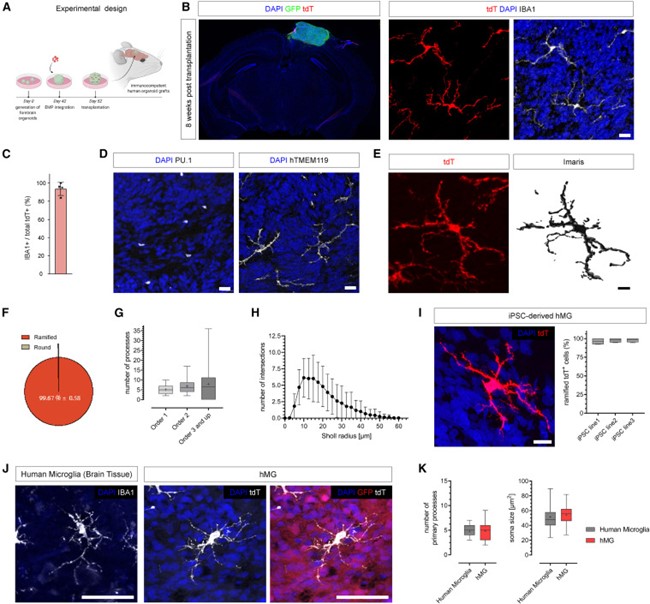
图4 移植使人小胶质细胞在人脑类器官中成熟并长期存活
为了进一步鉴定hMG在体内的分子特性,作者分离了tdT阳性/hCD45阳性细胞,并进行了scRNAseq。从1,027个tdT阳性细胞中,检测到6种分子上截然不同的小胶质细胞状态。所有分离的hMG都表达了典型的小胶质细胞标记AIF1、CX3CR1、CSF1R和CST3。其中第5组细胞表达了高水平的细胞周期进展相关基因,包括MKI67和RRM2。这一发现表明存在增殖性小胶质细胞亚群,与人类胎儿大脑中观察到的增殖性亚群一致。此外,0、1、2、3、4和5群中的大部分细胞都高表达成熟稳态小胶质细胞标记物P2RY12、TMEM119和SALL1。免疫组化分析也证实大部分hMG表达了P2RY12和hTMEM119(图5)。
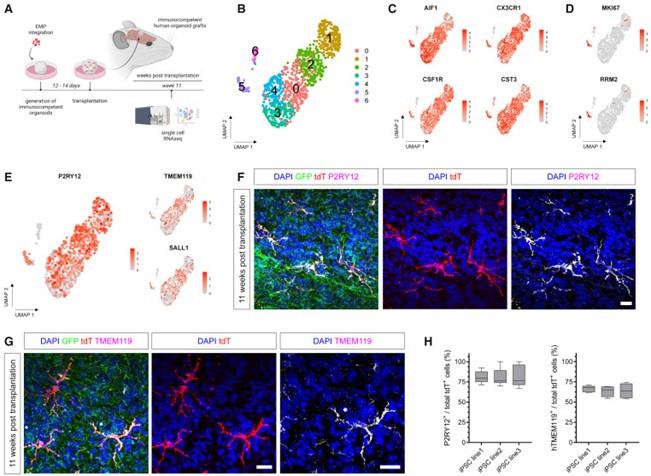
图5 体内hMG特性的转录组特征
考虑到CSF-1受体(CSF-1R)在小胶质细胞发育中的重要作用,作者接下来探讨了移植是否确实促进了其配体IL34和CSF-1在体内的内源性表达。在没有hMG的情况下生成的GFP阳性脑类器官上进行RNA测序能够描绘出移植后脑类器官中发生的转录组变化。在4-24个月期间出现了逐渐成熟的转变,这与人类大脑发育从胎儿早期向出生前晚期/出生后早期过渡的阶段十分吻合。与这一发现一致的是,上层标志物(如SATB2)以及表明成熟星形胶质细胞存在的标志物在体内随着时间的推移逐渐增加。移植后在类器官中检测到高水平的IL34和CSF1基因表达,而在体外培养时间匹配的脑类器官中则检测不到IL34。这些观察结果证实,移植的脑类器官为支持hMG的发育提供了有利的体内环境(图6)。
作者进一步从体内血管化的皮质器官组织中分离出了tdT阳性hMG,并将其与体外脑类器官中的相关细胞进行了比较,检测到了12种分子上截然不同的细胞状态。体内iHBO驻留的hMG表现出明显的突起复杂性增加,而体外类器官中的小胶质细胞在相应的时间点却没有发生这种明显的形态转变。此外,体内超过75%和70%的hMG表达的P2RY12和TMEM119,这在体外相应时间点的tdT阳性细胞中也未检测到。这些发现与移植后CSF-1R配体的上调一起,证实了类器官移植后的环境足以支持hMG的发育(图6)。
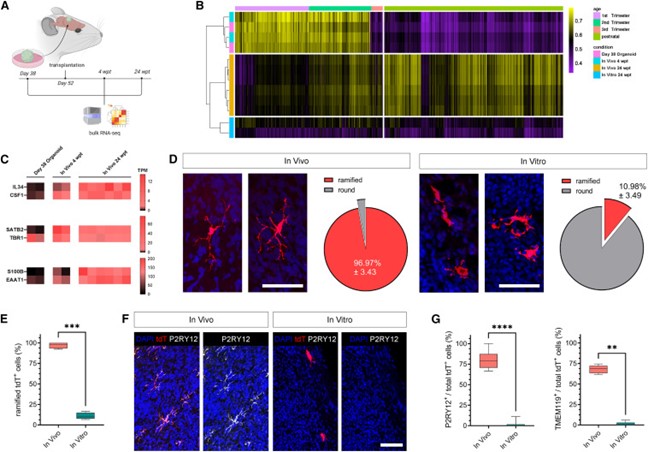
图6 移植的类器官支持体内稳态小胶质细胞状态的发育
为了进一步剖析体内系统中hMG特性的逐步获得,作者使用scRNAseq分析了移植后多个时间点的tdT阳性hMG。轨迹干扰分析显示了hMG不同的发育轨迹,细胞的拟时间排序与UMAP图中所代表的hMG的发育年龄非常吻合。其中,轨迹3与小胶质细胞的前期和早期状态有很强的对应性,而轨迹1和2则明显转向成年小胶质细胞状态。与这些观察结果一致,在人类胎儿小胶质细胞发育过程中发生显著变化的基因与研究的伪时间特征基因有明显重叠,其中包括CSF1R、C1QB和C3(图7)。
为了进一步评估hMG与人类小胶质细胞发育的再现程度,作者将scRNAseq数据与最近发表的参考数据集进行了比对,该数据集分析了9到18孕周hMG的发育情况。在人类数据集中观察到的小胶质细胞状态的特征性发育过渡在本研究中的hMG中得到了高度保留。与此一致,对3个发育时间点进行的差异基因表达分析表明,同源和小胶质细胞特异的感觉基因,如CX3CR1、P2RY12、SLCOB2C1和TMEM119以及TLR4等,出现了非常显著和持续的上调。令人震惊的是,与小胶质细胞感觉组的特异性上调一致,hMG在11-24个月期间获得了依赖于人脑环境的基因表达程序(图7)。
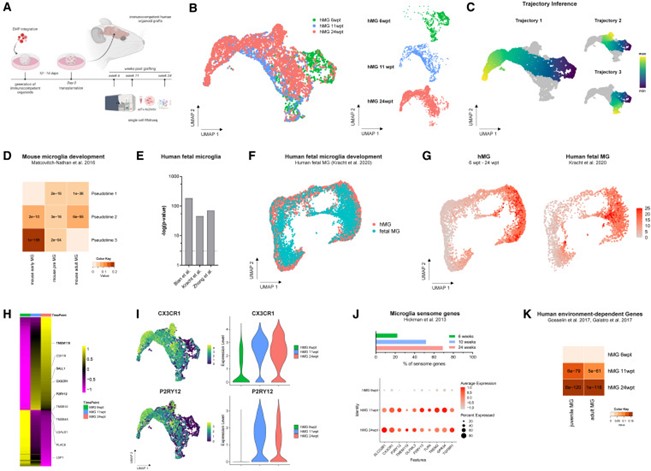
图7 hMGs遵循明确的发育轨迹,并在体内获得人脑环境依赖的特征
静息态小胶质细胞能够通过高度动态的突起来观察微环境。为了研究hMG是否再现了体内小胶质细胞的正常行为,作者利用双光子显微镜观察了体内人脑类器官组织中的tdT阳性hMG。对hMG的延时成像显示了高度分枝化的人体细胞,其突起具有显著的运动性,并通过分枝化过程的持续伸展和回缩参与对周围人体细胞环境的观察。这一观察结果与小胶质细胞在静息状态下感知微环境的功能一致(图8)。
有趣的是,与转录组数据一致,对hMG运动性的纵向评估显示,从6 wpt到24 wpt,基线运动性略有下降,但幅度显著。在12 wpt和24 wpt两个时间点之间没有观察到基线运动能力的明显差异。此外,从6 wpt到24 wpt,小胶质细胞的整体密度明显增加,而在24 wpt时则没有移行细胞(图8)。
为了研究hMG是否能够对环境诱导的扰动做出反应,作者接下来研究小胶质细胞在双光子诱导的局灶性激光损伤后的行为特征。激光诱导的人类类器官细胞损伤在12 wpt时引起了邻近tdT阳性hMG的立即反应,表现为突起向损伤部位快速定向延伸,这与之前描述的鼠小胶质细胞的行为一致。与小胶质细胞密度的增加一致,与24 wpt相比,12 wpt时小胶质细胞突起到达损伤部位的平均距离明显增加,进程延伸率也加快。因此,根据大脑发育过程中的不同阶段,损伤对单个小胶质细胞的影响也大不相同(图8)。
然后,作者评估了hMG在体内对全身性炎症刺激做出功能性反应的能力。鉴于小胶质细胞特异性感觉基因如TLR4在hMG中的表达,作者采用腹腔注射LPS的方法,引发快速的先天性免疫反应。在注射高剂量LPS 24小时后,观察到hMG形态发生了变化,表现为形态变圆、缺乏特征性原发突起以及大量丝状伪足从其基质延伸出来。较低剂量的LPS引起的形态变化不那么深刻。与转录组分析相一致,这些实验证实了人类同源和免疫传感小胶质细胞的存在,它们发挥着特有的监视功能,并对环境诱导的扰动和系统性炎症刺激做出反应(图8)。
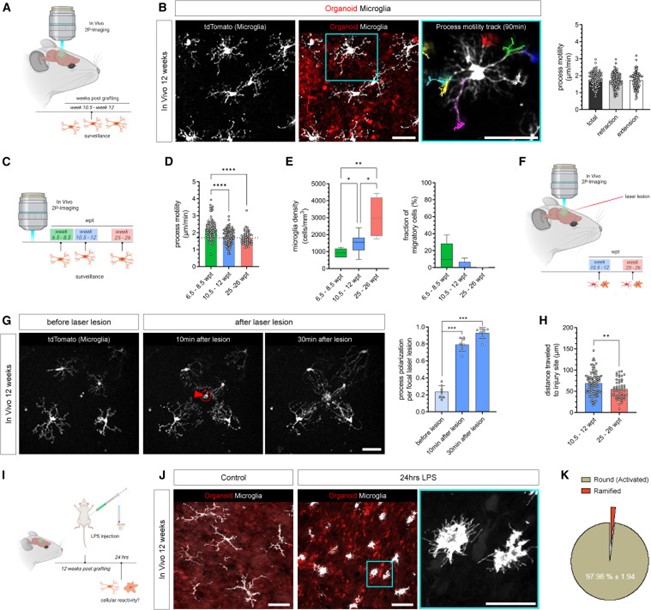
图8 hMG显示出特有的免疫传感特性,并对体内局部和全身性扰动做出反应
移植的iHBO模型的优势是能够通过跟踪发育过程中小胶质细胞与大脑相互作用的结果,利用同源患者研究人类特异性疾病。鉴于hMG具有免疫感应特性,作者试图确定这种模型是否可用于研究神经发育障碍背景下的人脑-小胶质细胞相互作用。为了建立患者特异性iHBO模型,首先从3名ASD患者和3名神经畸形对照者中产生了表达GFP和tdT的异源iPSC。然后从这些iPSC中生成了GFP阳性皮质类器官和tdT阳性EMP,并在整合后将iHBO模型移植到NOD/SCID小鼠的压后皮质中。在体内存活12周后,移植iHBO显示出hMG的明显增加,从细胞体中出现了过多的丝状伪足,与对照组相比,这是以牺牲特征性静息状态为代价的。形态学评估显示,ASD患者衍生的hMG具有明显增大的细胞体大小、明显增加的初级突起厚度和从突起中出现的丝状伪足数量。由3个独立对照iPSC衍生的iHBO模型中不存在反应性小胶质细胞表型(图9)。
为了评估在ASD患者衍生的iHBO中观察到的hMG表型是否确实是由改变的神经元环境诱导的,而不是由内在的小胶质细胞遗传易感性诱导的,作者制作了ASD患者和对照者特异性iHBO模型。使用这种方法发现,神经型hMG对ASD相关脑环境有反应,但对对照组脑环境没有反应,这表明在ASD小胶质细胞中观察到的形态学变化确实是由发育中的人脑环境变化驱动的(图9)。
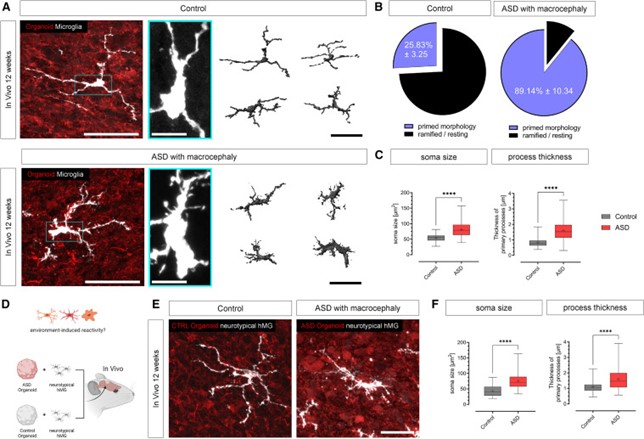
图9 患者特异性类器官模型的生成揭示了巨脑畸形ASD患者脑环境诱导的免疫反应
总之,该研究显示驻留在类器官的hMG获得了人类特异性的转录组特征,与其在体内的对应物非常相似。hMG积极参与监测人脑环境,对局部损伤作出反应,并对全身炎症信号作出反应。移植的iHBOs为研究健康和疾病中的功能性人类小胶质细胞表型提供了前所未有的机会,并为自闭症伴大头畸形患者特异性模型中的脑环境诱导免疫反应提供了实验证据。
参考文献:Schafer ST, Mansour AA, Schlachetzki JCM, Pena M, Ghassemzadeh S, Mitchell L, Mar A, Quang D, Stumpf S, Ortiz IS, Lana AJ, Baek C, Zaghal R, Glass CK, Nimmerjahn A, Gage FH. An in vivo neuroimmune organoid model to study human microglia phenotypes. Cell. 2023 May 11;186(10):2111-2126.e20. doi: 10.1016/j.cell.2023.04.022.