“文献精读系列”是脊柱脊髓损伤再生修复教育部重点实验室举办的常规科研交流学习会议,旨在聚焦领域内前沿进展,探究学术尖端技术研究路线,培养锻炼青年科研人员与硕博生科研思维。
【文献精读】会议日期:2023年12月21日 审校人/共同撰稿人:林古法 徐徐 报告人/撰稿人:梁文宇 编辑:宋思敏
如何恢复脊髓损伤后的行走能力一直是脊髓损伤领域的研究热点。早期研究发现,脊髓损伤区上方的部分神经元轴突可以再生并穿过胶质瘢痕边界,以及由非神经组织形成的损伤中心,重建与损伤区下方健康神经元的连接与突触接触,甚至还能恢复部分神经电信号的传导。然而,相关研究中的模型小鼠并未展现出显著的行走能力改善。这表明恢复神经功能的核心机制仍有待解析。2023年9月23日,由瑞士联邦理工学院Mark A. Anderson研究组、Gregoire Courtine研究组及Jordan W. Squair(第一作者)合作在Science上发表了题为Recovery of walking after paralysis by regenerating characterized neurons to their natural target region的研究论文,报导了通过多重治疗策略的干预促进特定胸椎神经元的再生与轴突生长,并形成其先天投射,传导来自运动皮层的信号至位于腰椎的行走中枢,从而恢复脊髓损伤后小鼠行走能力的发现。

为了鉴定具有向腰椎脊髓投射的神经元亚群,该研究利用AAV病毒注射标记了整个中枢神经系统中直接投射到腰椎脊髓的神经元的细胞核,对各个神经元亚群进行单核RNA测序。通过聚类分析,鉴定得到了28个表达典型标记基因的亚群,并依照特定的标准将它们进行了划分。其中,eGFPON神经元主要存在于胸椎神经元的单个腹侧神经元亚群(Hoxa7)中,该亚群表达标记物Vsx2和长距离投射神经元标记物Zfhx3,因此,研究者将其命名为SCVsx2::Hoxa7:Zfhx3→lumbar神经元(简称为SC神经元)。
研究者注意到,SC神经元仅在不完全性脊髓损伤情况下才成为行走功能的必需神经元,因此研究者试图探究SC神经元在脊髓自然恢复过程中是否发生转录紊乱。通过对比损伤后恢复小鼠与未损伤小鼠的神经元转录谱,发现其具有与先前snRNA-seq一致的神经元亚群数量。同时,在恢复行走的小鼠胸椎段的所有神经元亚群中,SC神经元表现出最明显的转录学变化,这些转录反应涉及树突棘形态发生途径、突触增强程序、肌动蛋白细胞骨架重组,所有这些变化都与脊髓自然恢复的过程相一致,证明了SC神经元是参与不完全性脊髓损伤后行走功能恢复的关键神经元亚群。(图1)
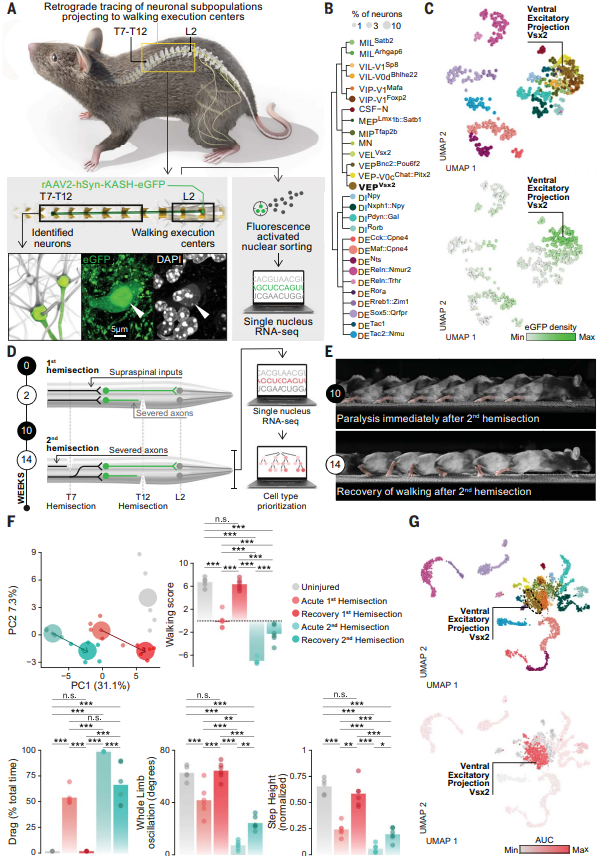
图1 参与脊髓先天修复的神经元的转录组学鉴定
鉴于SC神经元参与了脊髓损伤后行走能力的恢复,研究者假设这些神经元必须具有与恢复需求相符的连接组特征。研究者发现来自胸椎中段神经元的轴突投射密集地分布于腰椎脊髓的灰质中,为了鉴定其中由Vsx2ON神经元产生的轴突投射,研究者在Vsx2cre小鼠中使用交叉遗传学和病毒追踪比较了Vsx2ON神经元的分布情况和连接组特征,发现在整个腰椎脊髓中存在符合预期的来自此类神经元轴突的密集投射,且Vsx2ON神经元占胸椎中段脊髓神经元的5.9%。
随后,研究团队试图探究胸椎中部的Vsx2ON神经元是否可以分为局部型与远距离投射型两类亚群,利用AAV病毒注射特异性地标记了存在腰椎脊髓投射的Vsx2ON神经元。结果显示,Zfhx3和Vsx2仅在投射到该区域的神经元,也就是SC神经元中共定位。同时,局部与长距离投射Vsx2ON神经元的定量显示,这两个亚群在整个胸椎中段脊髓的含量几乎相等。这些发现证实,位于胸椎中段脊髓的Vsx2ON神经元的子集,即SC神经元,会共表达Zfhx3并存在腰椎脊髓投射。
与此同时,研究者推断,作为脊髓上游信号的传递者,SC神经元也必须能接收上游神经元的直接投射,并传递相关电信号。为了研究这一问题,研究者们特异性地标记了腹侧巨细胞核(vGi)以及神经元,并对Vsx2和表征突触点的vGlut2进行染色。结果表明,胸椎中段的SC神经元接受来自vGi神经元的投射,并且这种投射模式在损伤后恢复中保持不变(图2)
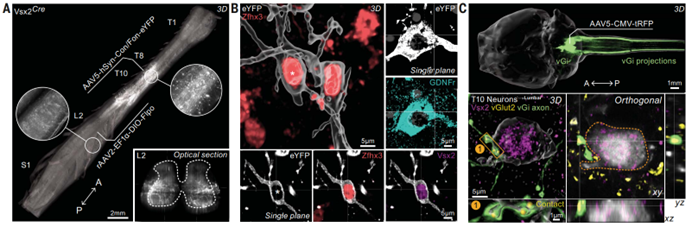
图2 SC神经元的投射与连接体特征图像
为了验证完全性脊髓损伤环境下的SC神经元是否可以重建其先天投射,课题组采用了先前研究中建立的三重再生策略,通过神经元再生能力的激活、神经生长基质的构建、神经营养因子的诱导,以促进轴突再生。课题组发现,在完全性脊髓损伤后,受刺激、支持的和化学诱导的轴突穿越了星形胶质细胞边界与纤维瘢痕,并进入了损伤区域下方的健康神经组织中。然而,轴突的再生停止于损伤下方仅一个节段处,此处恰好为搭载GDNF水凝胶注射的最远端,且没有发现小鼠行走能力任何恢复,这与非完全性脊髓损伤中的相关结果形成了鲜明对比。
针对这一现象,课题组认为远距离轴突的生长、成熟和突触形成的过程较为缓慢,并假设行走功能恢复所需的再生过程可能需要更为持续和更高浓度的生长因子递送。为了测试这种可能性,课题组设计了一种慢病毒来提供生长因子的持续递送,并用慢病毒介导的GDNF表达来取代载药水凝胶的注射。结果表明,两侧脊髓中的轴突均出现了显著再生,并能够抵达其位于腰椎脊髓的先天靶区,这进一步证明了适当的化学诱导梯度可以通过类似于发育的方式定向引导长距离轴突再生。
为了确定再生的轴突是否包括来自SC神经元的轴突,课题组特异性地在轴突再生至腰椎的神经元中表达eGFP,随后课题组对位于损伤上方的eGFPON神经元细胞核进行snRNA测序,并与未损伤的脊髓中神经元亚群的分布进行比较,发现SC神经元是主要的病毒标记亚群,这证实了在完全性脊髓损伤环境下,SC神经元的轴突也可以成功再生到其先天靶区。同时,转录谱显示,再生的SC神经元上调了轴突再生途径、Igf受体信号、突触形成和传递程序以及轴突延伸和成熟途径,这与它们在腰椎内的再生和稳定过程一致。
与此同时,课题组利用AAV病毒标记了神经元,并对腰椎脊髓中Vsx2和Chat神经元进行免疫学标记。结果显示,再生的轴突抵达并接触了与行走功能相关的神经元亚群。与此同时,未受伤的小鼠也表现出类似的投射模式,这表明再生的SC神经元轴突或能自发地重塑其与先天靶点的适当连接。此外,课题组还发现,对vGi的微刺激引起了损伤后恢复小鼠的腿部肌肉中显著的运动诱发电位,表明脊髓上游中枢系统到腰椎脊髓的功能通路已经得到恢复。(图3)
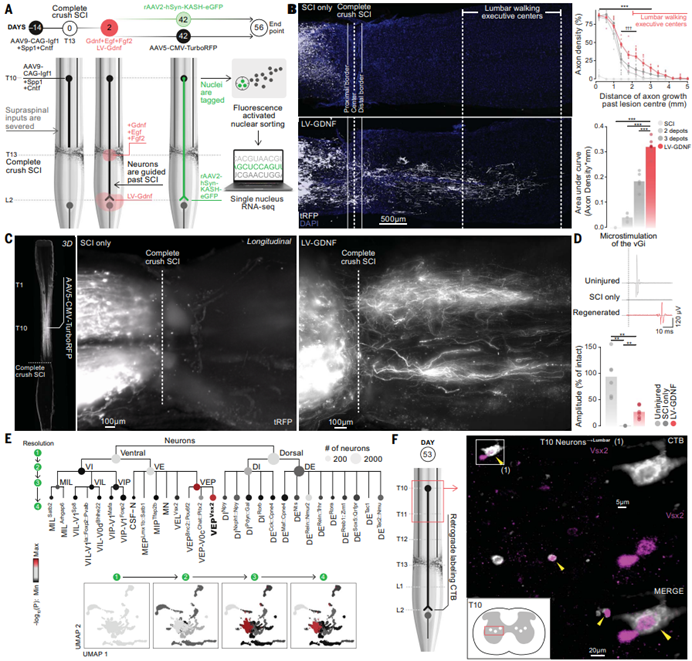
图3 SC神经元再生并穿越了完全性脊髓损伤区域
鉴于前文中的三重治疗策略对SC神经元恢复的促进与诱导作用,课题组猜想该策略或能实现完全瘫痪后行走能力的恢复。因此,课题组对五组接受完全性脊髓损伤并接受再生治疗的小鼠进行了行走时全身运动学的评估。评估显示,脊髓损伤使每只小鼠的腿部运动消失。而在所有治疗组小鼠中,再生策略促进了SC神经元向其自然靶区的生长,这一再生过程与损伤后3至4周出现的腿部运动功能的恢复相吻合。最终评估在第8周进行,在所有的30只小鼠中,有27只小鼠展现了行为表型的明显改善。这些结果表明,课题组采用的多重治疗策略导致了完全性脊髓损伤后行走能力的大幅恢复。
鉴于SC神经元参与了不完全性脊髓损伤后的自然恢复,课题组测试了SC神经元在再生后行走能力恢复中的必要性。为此,其在Vsx2Cre小鼠胸脊髓中表达了白喉毒素受体(DTR)来消融Vsx2神经元。在白喉毒素给药后,每只受试小鼠都出现了再次瘫痪。解剖学分析证实受试小鼠胸脊髓的Vsx2ON神经元几乎完全消融。这些结果证实了胸椎脊髓Vsx2ON神经元在再生后行走恢复中的作用。
随后,课题组进一步测试了SC神经元向腰椎脊髓的投射在完全性脊髓损伤后行走恢复中的必要性。通过特定的AAV病毒注射,一旦小鼠表现出行走能力的实质性恢复,就可以沉默再生的SC神经元。CNO的使用立即损害了所有小鼠的行走能力,导致其步态模式与未经历再生治疗的小鼠相似。相比之下,未接受注射的小鼠不受CNO给药的影响。以上的这些发现表明,SC神经元向其先天靶区的轴突投射再生有助于完全性脊髓损伤后行走能力的实质性恢复。(图4)
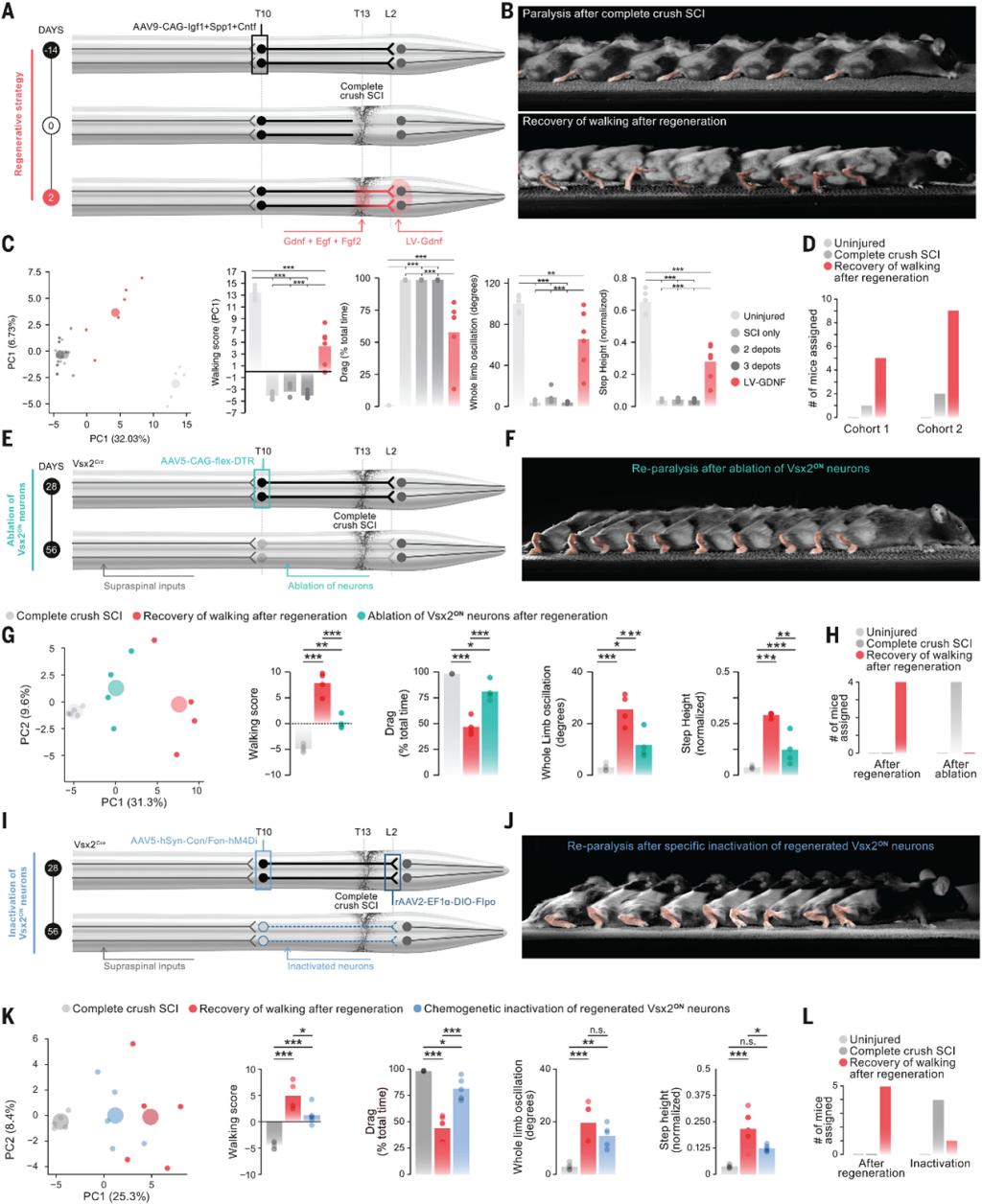
图4 SC神经元的轴突再生是完全性脊髓损伤后行走能力恢复所必需
总之,在本工作中,课题组主要研究了完全性脊髓损伤中关键神经元轴突再生并形成先天投射对损伤后行走能力实质性恢复的重要性。为了解决这一问题,课题组首先表征了胸椎脊髓中与行走功能恢复相关的神经元亚群的分子特征,并对这一关键神经元的连接体特性进行了表征,发现其先天投射可以延伸至腰椎脊髓中行走中枢的节段处。随后,课题组采用多管齐下的再生治疗策略,在完全性脊髓损伤环境下刺激关键神经元轴突穿过损伤区域,再生至损伤下方的健康神经组织中,并形成先天投射。此外,课题组利用轴突投射特异性的snRNA-seq鉴定了关键神经元亚群的转录学特性,并证明了其与先前研究得到的不完全性脊髓损伤中的关键神经元亚群相一致,从而实现了轴突投射再生策略由不完全损伤向完全性损伤的拓展。
参考文献:Squair JW, Milano M, de Coucy A, Gautier M, Skinnider MA, James ND, Cho N, Lasne A, Kathe C, Hutson TH, Ceto S, Baud L, Galan K, Aureli V, Laskaratos A, Barraud Q, Deming TJ, Kohman RE, Schneider BL, He Z, Bloch J, Sofroniew MV, Courtine G, Anderson MA. Recovery of walking after paralysis by regenerating characterized neurons to their natural target region. Science. 2023 Sep 22;381(6664):1338-1345. doi: 10.1126/science.adi6412. Epub 2023 Sep 21. PMID: 37733871.