“文献精读系列”是脊柱脊髓损伤再生修复教育部重点实验室举办的常规科研交流学习会议,旨在聚焦领域内前沿进展,探究学术尖端技术研究路线,培养锻炼青年科研人员与硕博生科研思维。
【文献精读】会议日期:2024年6月5日 审校人:朱颜菁 报告人/撰稿人:庞雪宁 编辑:宋思敏
人类神经系统是最复杂却又高度组织有序的器官之一,其复杂性和组织性源于神经管发育过程中神经管图式形成。目前常用的基于多能干细胞的神经发育模型,如神经类器官和生物工程神经管(NT),虽然在一定程度上模拟了中枢神经系统的局部发育,但往往难以全面再现神经管沿头-尾轴和背-腹轴的立体结构与分区特征。这限制了我们对人类神经系统早期发育机制的深入理解。
2024年2月26日,美国密西根大学Jianping Fu院士团队建立了一种基于微流控技术的人类多能干细胞驱动的神经管样结构(μNTLS)模型。该模型巧妙利用了微接触印刷和微流体梯度技术,引导人类多能干细胞沿头-尾轴(R-C轴)和背-腹轴(D-V轴)有序分化,从而在三维环境中重建了神经管的典型区域分布,包括前脑、中脑、后脑和脊髓。作者利用该模型研究了神经细胞谱系发育,揭示了神经嵴(NC)祖细胞轴向化,以及神经中胚层祖细胞(NMP)和尾部基因CDX2在脊髓和躯干神经祖细胞发育中的功能。并建立了D-V模式的微流控前脑样结构(μFBLS)类器官,其背侧和腹侧区域在空间上相互分离,顶端和基底细胞组织分层,模拟了人类前脑大脑皮层和大脑皮层下层发育过程。总之,该模型为研究人类中枢神经系统的早期发育以及不同疾病病理机制研究提供了一个强大的平台,以题为“A patterned human neural tube model using microfluidic gradients”发表在《Nature》上。

【头-尾轴图式的人类微流控神经管样模型构建】
人类神经管沿头-尾轴(R-C轴)可划分为前脑、中脑、后脑和脊髓4个主要区域。在人类神经管发育过程中,神经孔在CS12阶段关闭,形成完全封闭的神经管。此时神经管头-尾轴长度约为4 mm,脊髓区域沿背-腹轴高度约为200 μm。为了开发微流控神经管样结构,作者利用微接触印刷来打印一系列 Geltrex 粘合区域(长度:4 mm;宽度:100 μm),以引导人类多能干细胞形成固定尺寸的集落。沿着人类多能干细胞集落的长度(R-C轴)或宽度(D-V轴),在微流体装置的图案形成区域内建立了可控的化学梯度。
人胚胎干细胞在第0天加载到中央通道中,仅附着在Geltrex区域上,然后形成矩形细胞集落。第1天将100% Geltrex溶液加载到中央通道中并在中央通道的两个储存库中添加神经元诱导培养基。第2天人胚胎干细胞集落自组织并沿着头-尾轴出现ZO-1+神经管管腔。第2天到第5天,CHIR99021(一种WNT通路激活剂)、FGF8和RA被补充到中央通道的右侧储存库中,从而在图案区域形成可控的化学梯度。待培养到第7天,可明显检测到HOX1-HOX9蛋白沿头-尾轴表达,表明此时μNTLS已形成前脑、中脑、后脑和脊髓区域。但是μNTLS尾部形成的仅是胸段脊髓区域。作者证明μNTLS的头-尾轴图式的重复性非常高,使用多种人类多能干细胞系(包括人类诱导多能干细胞系)的成功率可达90.9±3.7%(平均值±SEM)。
在小鼠中,神经中胚层祖细胞在胚胎第8 - 8.5天的尾部尾芽中出现。 作者探究了神经中胚层祖细胞在μNTLS中的发育。发现SOX2+ Brachyury+神经中胚层祖细胞仅在第3-5天短暂出现在μNTLS尾端。并且这些细胞还表达尾部标记蛋白CDX2。作者使用TBXT::T2A-Cre(Tbxt编码Brachyury)谱系追踪人类胚胎干细胞系,证实了μNTLS尾端的神经中胚层祖细胞后代有助于HOXC9+胸段脊髓区域的发育。
区域特异性神经球体微流控平台可用于生成区域特异性微流控神经球体(μNS)类器官。作者在图案化区域形成了一系列圆形人类胚胎干细胞集落,并且采用同样的培养方案。与μNTLS的发育类似,圆形人类胚胎干细胞集落自组织并形成管腔球体。基于OTX2、PAX6和 HOX基因的表达,μNS具有前脑、中脑、后脑和脊髓区域按头-尾轴顺序在规定位置上分布。
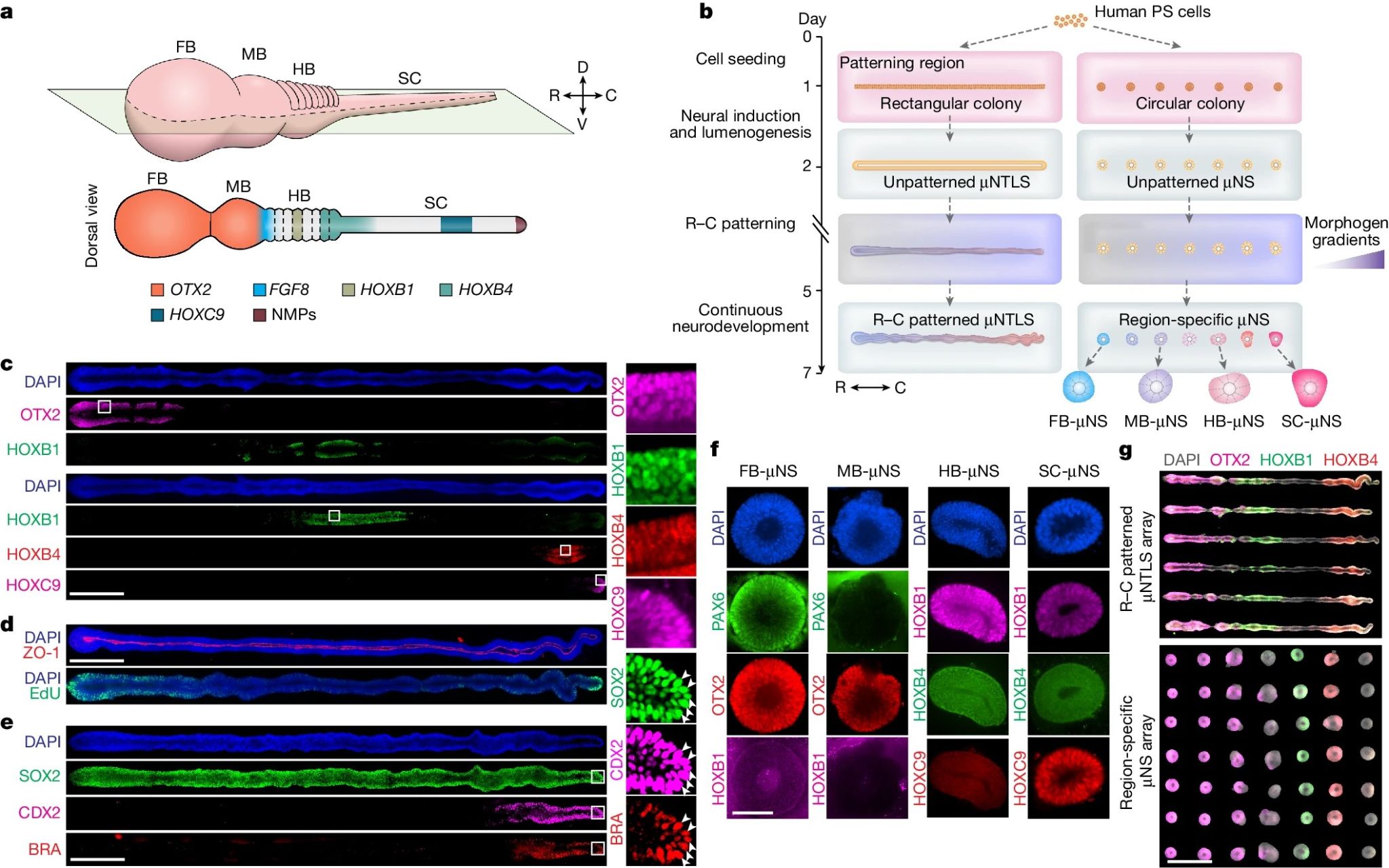
图1 使用微流体技术形成头-尾轴图式的人类神经管样模型
【头-尾轴和背-腹轴图式的人类微流控神经管样模型构建】
神经管沿背腹轴的发育图式,是由复杂的信号调控机制所决定的。背侧非神经外胚层和顶板分泌的形态发生素BMP和WNT,以及腹侧脊索和底板分泌的SHH信号,通过相互拮抗的浓度梯度共同诱导产生了神经管的背腹轴图式。此外,轴旁中胚层还分泌RA,在神经管腹侧化过程中也扮演重要角色。研究者们利用微流控技术,在体外重建了这一神经管发育的关键过程。作者在微流控装置的图案化区域中心诱导生成了单个具有头-尾轴和背-腹轴图式的μNTLS。具体操作是,人胚胎干细胞在第2-5天进行头-尾轴诱导后,第6-9天在微流控装置的上下两个通道添加BMP4与RA/SHH以诱导背-腹轴图式。结果发现,μNTLS仍然保持明显的头-尾轴图式,并且其头端区域在第5天开始迅速扩张。到第9天,头侧μNTLS中的所有细胞均表达大脑皮层标记物,但不表达大脑皮层下层标记物。但此时尾部脊髓区域则呈现出典型的背-腹轴结构特征。值得注意的是,由多种人类多能干细胞系生成的头-尾轴和背-腹轴图式μNTLS成功率高达86.03±2.93%。为了进一步延长了μNTLS的发育时间,作者在第9天将其剥离微流控装置放在Geltrex凝胶中于神经发育条件下继续培养至21天。可发现μNTLS持续生长,其中头侧μNTLS区域的扩张最为显着,但尾端神经孔保持开放形式并没有产生闭合。此时,μNTLS沿背腹轴呈现出有序的基因表达模式,与前脑和脊髓的结构特征高度吻合。
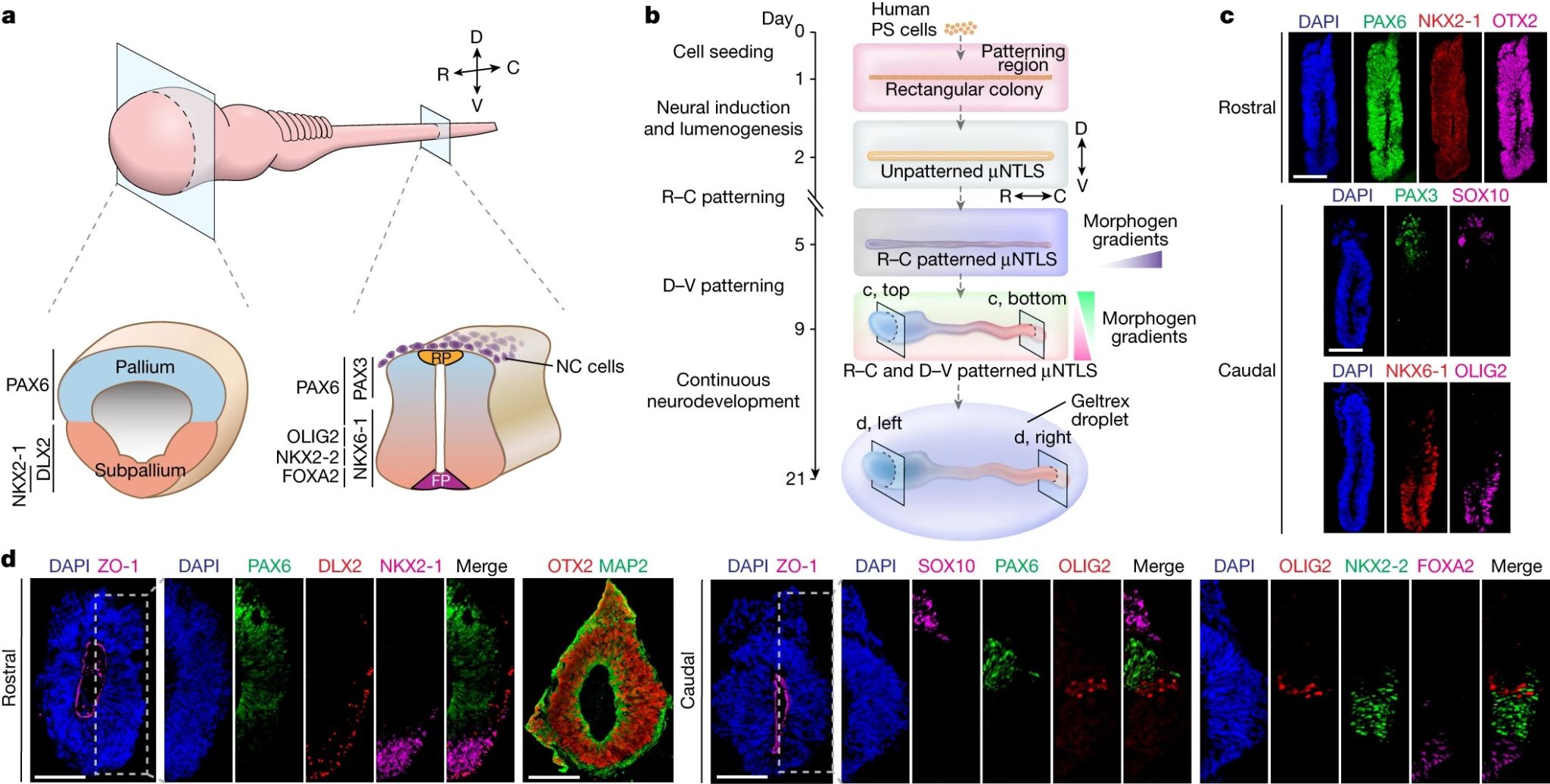
图2 使用微流体技术形成头-尾轴和背-腹轴图式的人类神经管样模型
【单细胞转录组测序分析微流控人类神经管的图式形成】
作者应用单细胞RNA测序(scRNA-seq)对第4天头-尾轴图式的μNTLS以及第9、21天的头-尾轴和背-腹轴图式μNTLS进行转录组分析。基于谱系标记蛋白,细胞被分为10个不同的群体,分别为前脑、中脑、峡部、后脑、脊髓、神经中胚层祖细胞、顶板、底板、神经嵴祖细胞和神经元。并发现神经中胚层祖细胞簇仅在第4天μNTLS中存在,这与这一细胞群具有短暂存在的发育特点相吻合。而神经元群落则是在第9天的μNTLS中首次出现,并在随后21天的培养期内数量迅速增多。进一步的RNA velocity分析预测,前脑、中脑、后脑和脊髓等各区域的祖细胞群落,都参与了μNTLS的神经发生过程。这表明,不同区域的祖细胞协同作用,共同推动了μNTLS的神经发育。作为对比,作者还将第9天和第21天的μNTLS转录组数据,与人类早期胚胎(CS12-CS16期)的scRNA-seq数据进行了比较分析。结果显示,第9天的μNTLS与CS12期的人类胚胎,第21天的μNTLS与CS15-CS16期的人类胚胎,具有最接近的转录组谱系特征。这进一步验证了μNTLS在体外成功模拟了人类神经管发育的关键时期。
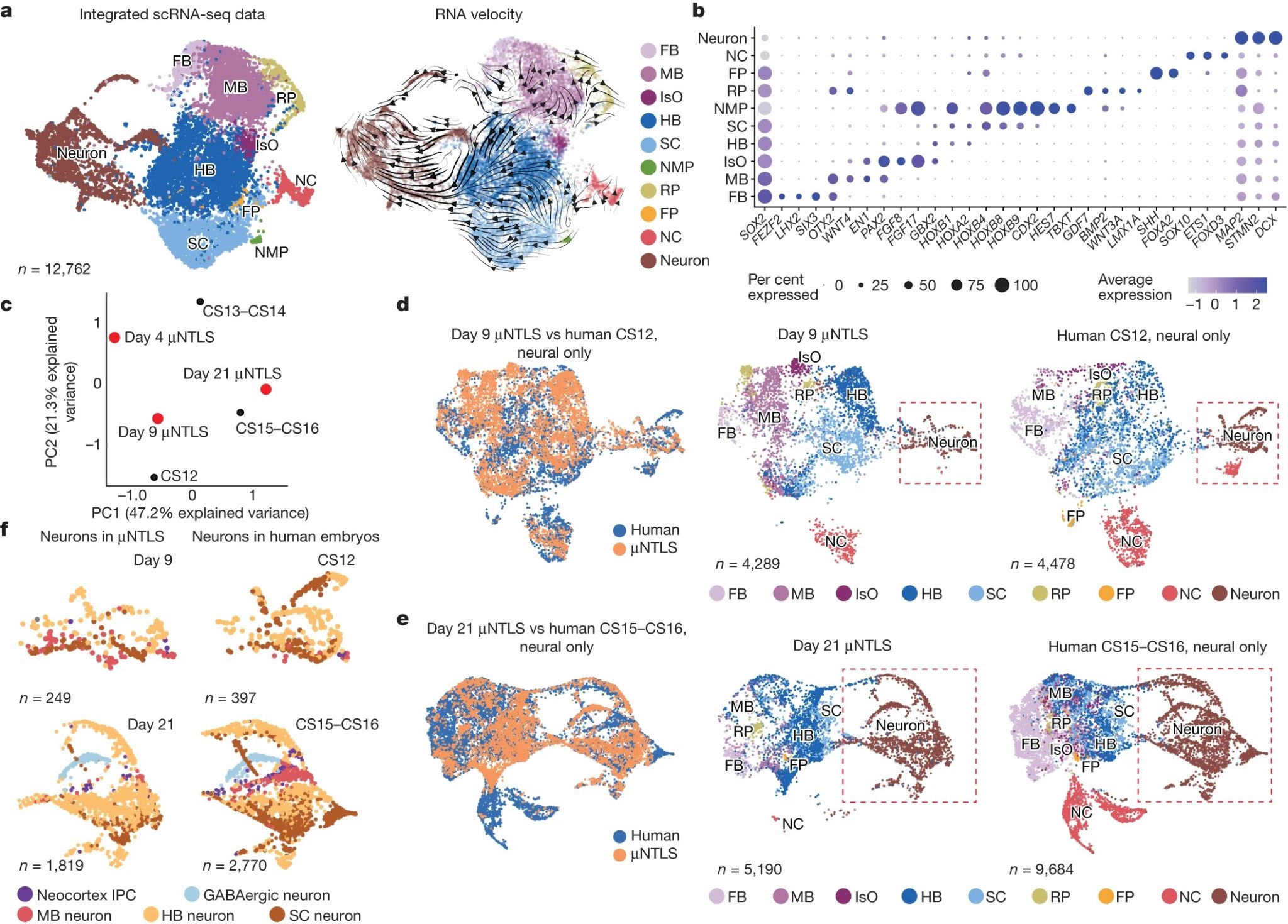
图3 单细胞转录组测序分析μNTLS
【微流控人类神经管样模型中神经嵴祖细胞发育】
神经嵴祖细胞是一类具有多向分化潜能的特殊细胞群,它们起源于神经板边界,并经历从上皮到间充质的转化过程。这一过程使神经嵴细胞得以从神经管背侧脱离,沿着头-尾轴向不同方向迁移分化。有趣的是,神经嵴祖细胞在不同轴向上表现出明显的发育潜能差异。颅脑神经嵴祖细胞更倾向于分化为间充质细胞,而躯干神经嵴祖细胞则更易产生神经谱系,如交感神经元。在11天诱导的μNTLS模型中,作者发现SOX10+神经嵴祖细胞位于μNTLS的背侧,与之相邻的μNTLS表达上皮-间质转化标记物SNAI2蛋白。此时,TWIST1+间充质细胞仅在μNTLS的头端与SOX10+神经嵴祖细胞相邻。相反,PHOX2B+交感神经元仅在尾部与SOX10+神经嵴祖细胞相邻。而ISL1+感觉神经元和S100B+雪旺细胞在整个头-尾轴均可检测到。由于神经嵴祖细胞仅在μNTLS的背-腹侧发育阶段出现,而神经嵴祖细胞沿头-尾轴又暴露于相似的微环境下,为了确定神经嵴祖细胞的轴向特性,作者在μNTLS头-尾轴图式建立后,在背-腹侧发育阶段WNT,FGF8和RA等信号梯度被逆转。发现这种改变并不影响间充质细胞以及交感神经元表达位置的变化。因此,神经嵴祖细胞的轴向特性可能在μNTLS的头-尾轴发育阶段预先形成。
源自人多能干细胞的神经中胚层祖细胞可以在体外分化为躯干神经嵴祖细胞,这表明躯干神经嵴祖细胞可能来自于神经中胚层祖细胞。作者使用TBXT::T2A-Cre谱系示踪细胞系生成μNTLS,发现神经中胚层祖细胞分化为HOXC9+躯干神经嵴祖细胞、ISL1+感觉神经元和PHOX2B+交感神经元。
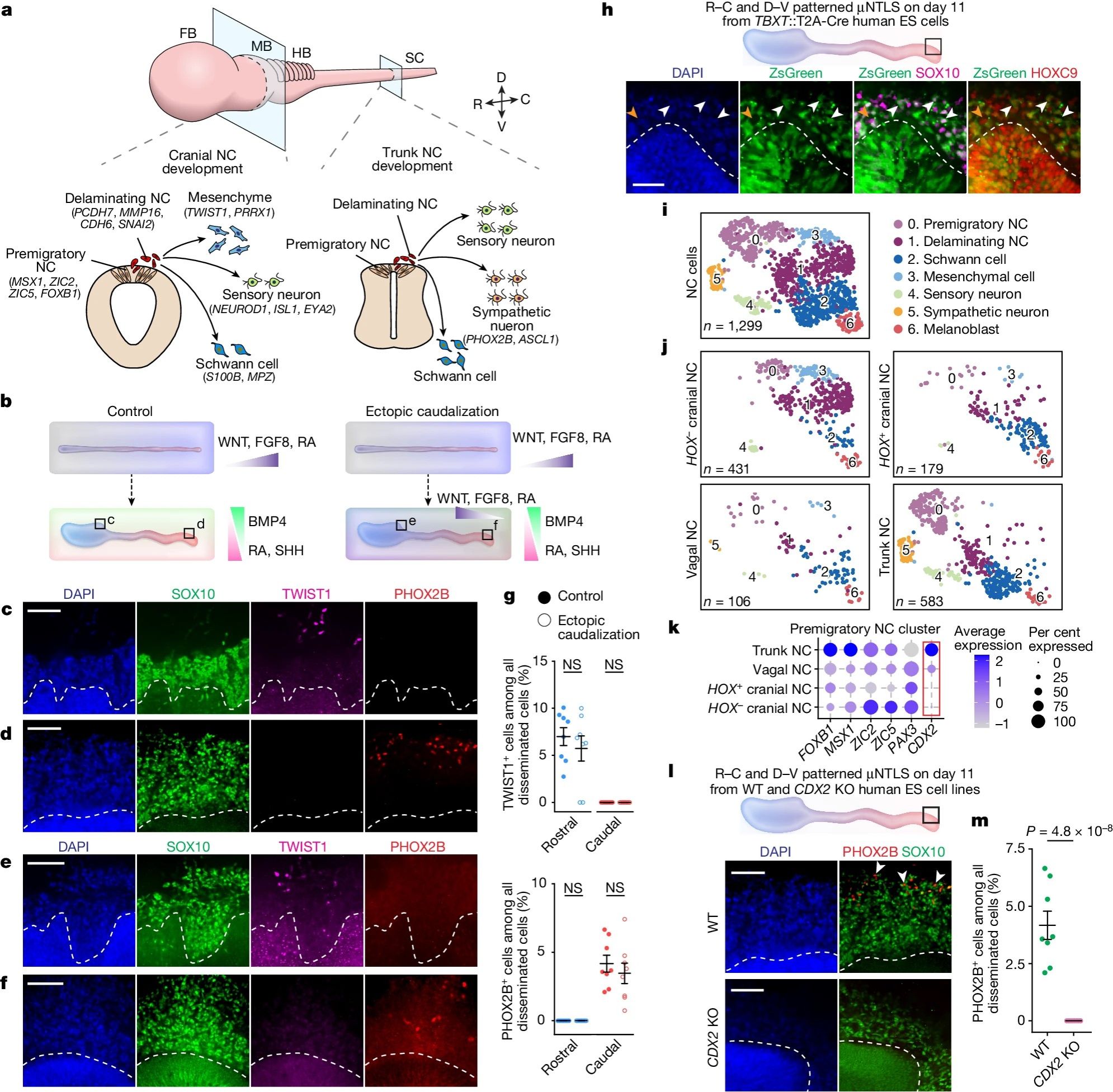
图4 μNTLS中神经嵴祖细胞发育
【背-腹轴图式的人类微流控前脑类器官模型构建】
接着作者使用微流控装置构建背侧、腹侧以及背-腹侧图式的人类微流控前脑类器官(μFBLS)模型。具体来说,在前5天的分化过程中,各组μFBLS的培养条件保持一致。第5-9天,若所有培养基储存库中添加神经元诱导培养基以产生背侧μFBLS;若所有培养基储存库中添加含有SAG的神经元诱导培养基可以产生腹侧μFBLS;若在上下两个通道的培养基中分别添加BMP4和SAG,则生成背-腹侧轴图式的μFBLS。在第9天将PDMS结构层与玻璃片分离,μFBLS保留在PDMS结构层上,并在添加含胰岛素和1% Matrigel的基础培养基连续培养至第40天。第40天时,66.4±4.1%的背侧μFBLS和60.0±4.8%的腹侧μFBLS均含有一个神经管腔。更为重要的是,背-腹轴图式的μFBLS清晰展现了背侧区域TBR1+皮质神经元和腹侧区域的DLX2+皮质下神经元的空间分离,与生理发育过程高度相符。
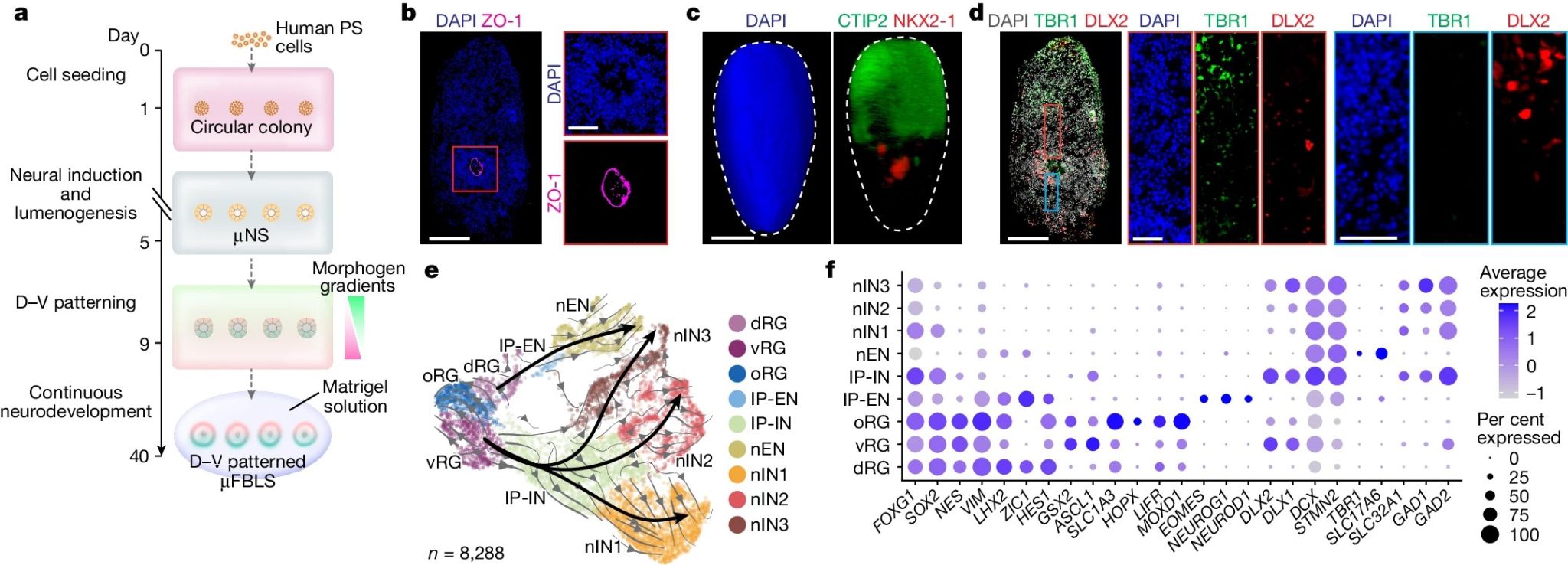
图5 背-腹轴图式的人类微流控前脑类器官
参考文献:
Xue, X., Kim, Y.S., Ponce-Arias, AI. et al. A patterned human neural tube model using microfluidic gradients. Nature 628, 391–399 (2024). https://doi.org/10.1038/s41586-024-07204-7