新型纳米材料MgFe-LDH
胚胎干细胞(ESCs)具有自我更新和多向分化潜能,能被诱导分化为机体几乎所有细胞类型,具有重要的再生修复研究和应用价值。维持其干性对于ESCs的培养扩增至关重要,经典方法通常采用白血病抑制因子(LIF)维持其干性,但有潜在的内毒素污染和生产成本较高等问题,因此研发可替代的新型材料是该领域的热点前沿方向。
2021年2月25日,同济大学附属同济医院/脊柱脊髓损伤再生修复教育部重点实验室朱融融教授在国际知名学术期刊Advanced Science杂志上在线发表了题为《MgFe‐LDH Nanoparticles: A Promising Leukemia Inhibitory Factor Replacement for Self‐Renewal and Pluripotency Maintenance in Cultured Mouse Embryonic Stem Cells》的研究论文。

该研究研制出一种新型镁铁层状双氢氧化物(MgFe‐LDH)纳米材料,可以有效替代LIF维持小鼠胚胎干细胞(mESCs)的自我更新,表现在高水平的碱性磷酸酶活性及自我更新相关基因和蛋白的高表达(图1A,B)。MgFe‐LDH体系和LIF体系下培养的细胞一样,具有形成拟胚体和畸胎瘤的能力,且保有多向分化潜能(图1C)。以上说明添加MgFe‐LDH能够很好地保留mESCs自我更新和多向分化潜能这两个特性,可实现无LIF的mESCs培养。
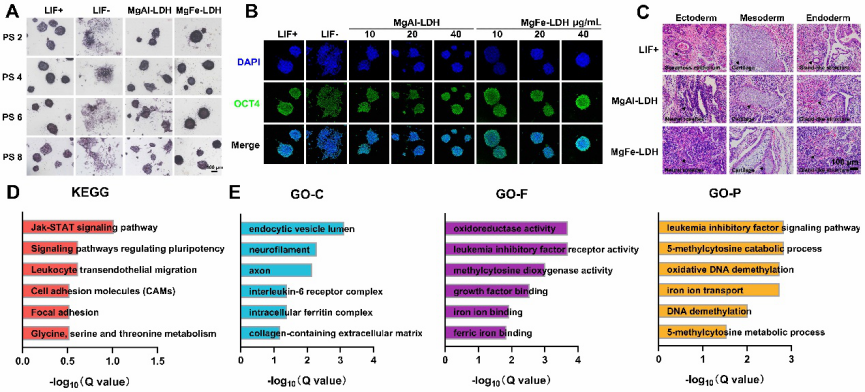
图1. MgFe‐LDH替代LIF维持小鼠胚胎干细胞干性及测序分析
该工作通过转录组和蛋白组学测序关联分析,筛选并分析了44个关键基因(图1D,E),其中白血病抑制因子受体(LIFR)是MgFe‐LDH维持小鼠胚胎干细胞干性的关键靶点。MgFe‐LDH一方面可以通过激活LIFR影响下游的JAK/STAT3和PI3K/AKT信号通路,提高干性基因表达;另一方面,MgFe‐LDH缓释出的铁离子能够促进TET1/2的表达,进而影响DNA去甲基化相关进程,最终维持ESCs干性(图2)。
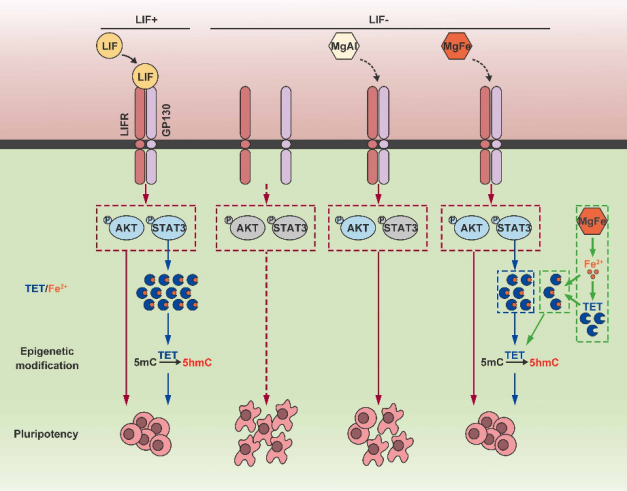
图2. MgFe‐LDH维持干性的机制示意图
综上所述,该项研究研制出可替代LIF因子的MgFe‐LDH纳米材料,实现了无LIF的胚胎干细胞培养,并揭示其机制与LIFR以及下游甲基化进程相关,为胚胎干细胞的培养扩增提供了一个极具应用前景的新材料,为干细胞转化医学研究提供了新思路。