“文献精读系列”是脊柱脊髓损伤再生修复教育部重点实验室举办的常规科研交流学习会议,旨在聚焦领域内前沿进展,探究学术尖端技术研究路线,培养锻炼青年科研人员与硕博生科研思维。
【文献精读】会议日期:2024年3月19日 审校人:阳乐涛 林古法 报告人/撰稿人:戴晔菲 编辑:宋思敏
近年来,细胞膜包被纳米颗粒(cell membrane-coated nanoparticles, CNPs)在疾病的诊断、治疗和预防方面显示出巨大的前景。通过用天然细胞膜包覆纳米颗粒,所得的CNPs可以展示一系列细胞表面标记,使它们能够模拟自然的细胞相互作用并用于一系列生物医学应用。除了天然膜覆层之外,研究人员还开发了通过脂质插入、化学偶联、代谢工程和基因工程等增强CNPs功能的方法。特别是,基因工程已被证明是一种强大而灵活的方法,可以引入新的蛋白质来增强纳米颗粒的功能,包括免疫调节、疾病靶向和内体逃逸。
2023年10月30日,美国加利福尼亚洲拉霍亚加州大学圣地亚哥分校纳米工程系、化学工程项目和摩尔斯癌症中心张良方团队在《Nature Nanotechnology》期刊发表了题为“A modular approach to enhancing cell membrane-coated nanoparticle functionality using genetic engineering”的研究文章,展示了一种基于基因工程的CNPs模块化功能化方法,该方法可以将各种配体包裹在纳米颗粒表面上。经过基因工程编辑的细胞膜覆层可以表达SpyCatcher 细胞膜锚,该锚可以很容易地与任何带有 SpyTag修饰的部分形成共价键。通过三种具有不同类别的锚重复蛋白、亲和体和单链可变片段的靶向配体生成了独特的靶向 CNPs制剂,证明了该技术的广泛实用性。在体外,修饰后的纳米颗粒对过表达每个配体同源受体的细胞系表现出更强的亲和力。当负载化疗药物时,模块化功能化的纳米颗粒在卵巢癌的小鼠肿瘤异种移植模型中表现出强大的靶向能力和生长抑制作用。本文数据表明,基因工程为加速开发能够广泛应用于生物医学的多功能CNPs提供了一种可行的方法。
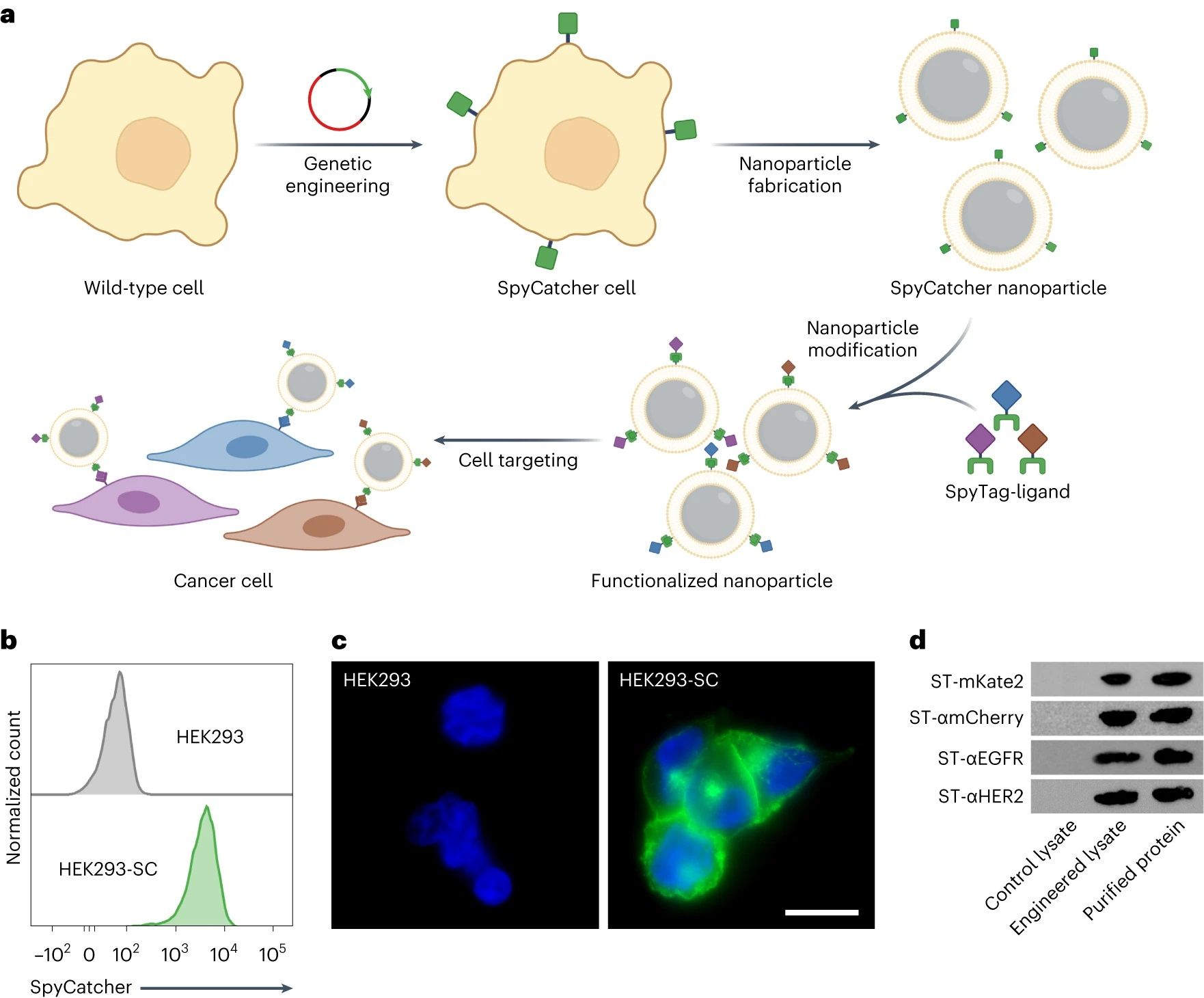
图1. SpyCatcher表达细胞和SpyTag标记配体的工程和表征
SpyCatcher表达细胞和SpyTag标记配体的工程
通过基因工程细胞膜开发了一个模块化的 CNP 平台,以表达SpyCatcher 作为锚点。将改性的膜涂覆在纳米颗粒核心上后,所得基础纳米制剂可以用 SpyTag标记的配体进行功能化(图1a)。使用三种不同的SpyTag标记的靶向分子证实了这种方法的模块化。在体外,每种制剂都显示出对过表达相应受体的细胞的亲和力。使用多西他赛作为模型药物,证明增强的靶向能力显着增加了对靶细胞系的细胞毒性活性。在小鼠肿瘤模型中,实现了强大的靶向和生长抑制。这项工作表明,模块化设计原则可以使CNP 平台开发受益,从而可以预见地简化有用功能的引入,而无需耗时的工程设计。
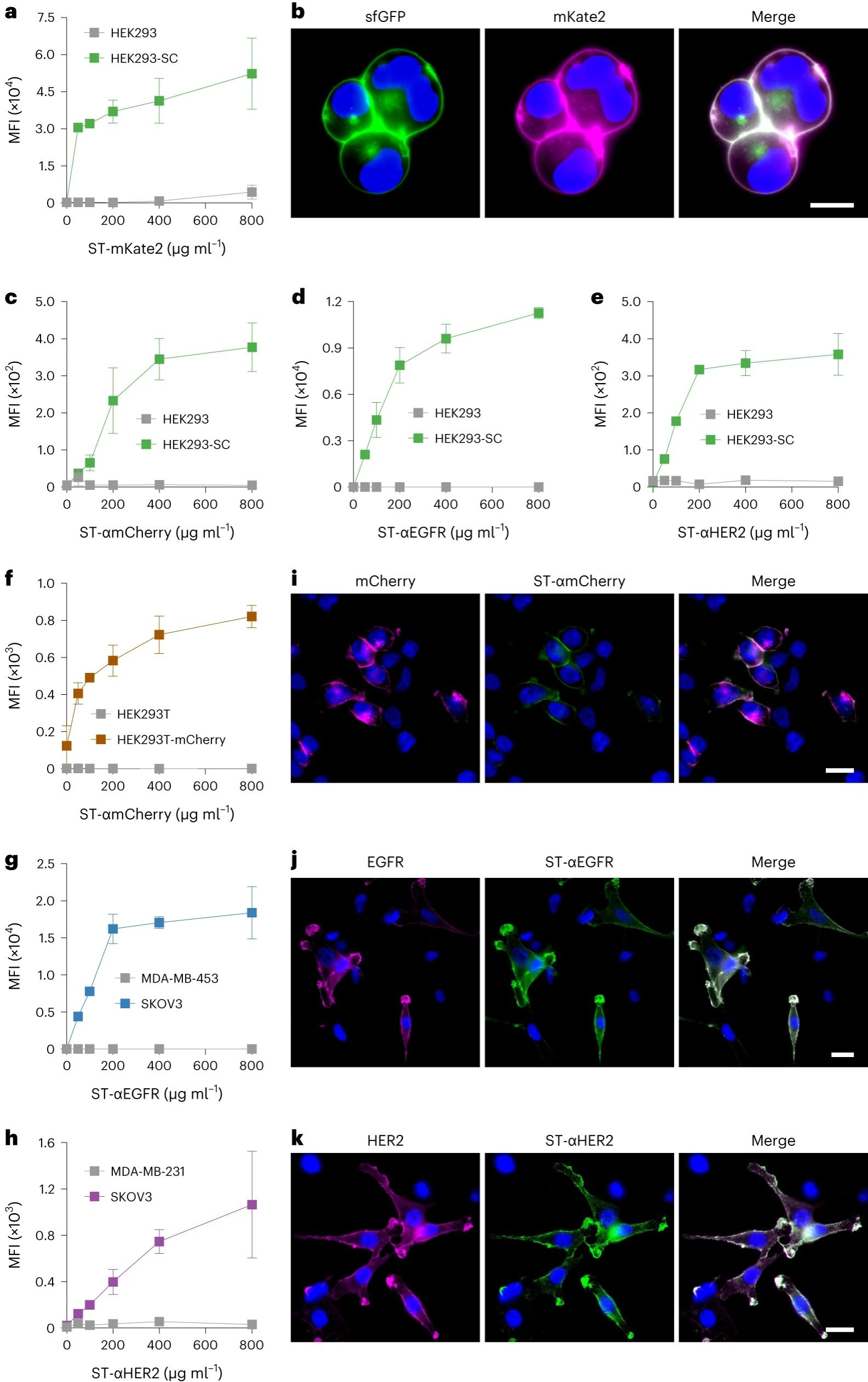
图2. SpyTag标记配体的功能表征
体外细胞靶向
将SC-NP与 ST-αmCherry、ST-αEGFR 和 ST-αHER2 孵育以产生相应的靶向纳米制剂(表示为 αmCherry-NPs、αEGFR-NPs 和 αHER2-NPs)。首先,将αmCherry-NPs与HEK293T-mCherry细胞一起孵育,并使用流式细胞术观察剂量依赖性靶向。同样,αEGFR-NPs和αHER2-NPs都能有效地靶向EGFR和HER2阳性的SKOV3细胞,而SC-NPs与细胞的相互作用非常有限。靶向特异性在共培养测定中得到证实,其中模块化功能化的纳米颗粒与其同源受体阳性和阴性的细胞混合物一起孵育。每种纳米制剂优先结合到适当的靶细胞上,通过荧光成像和流式细胞术验证。在相应的游离可溶性配体作为封闭剂的存在下,还评估了每种功能化纳米制剂的结合。为了评估模块化CNP制剂在癌症治疗中的潜力,研究者选择了多西他赛(DTX)作为模型化疗药物。该药物通过疏水相互作用封装到自组装的PLGA核心中。然后用ST-αmCherry、ST-αEGFR或ST-αHER2对所得的DTX负载的SC-NPs(表示为SC-[DTX]NPs)进行官能化,以产生相应的靶向纳米制剂(表示为αmCherry-[DTX]NPs、αEGFR-[DTX]NPs或αHER2-[DTX]NPs)。然后将每个靶向纳米颗粒与表达同源受体的癌细胞一起孵育15分钟,之后将任何未结合的纳米颗粒洗掉。再孵育3天后,测量每种制剂的细胞毒性。αmCherry-[DTX]NPs对HEK293T-mCherry细胞非常有效,其半数最大抑制浓度(IC 50)为4.0ng/ml。同样,αEGFR-[DTX]NPs 和αHER2-[DTX]NPs 对SKOV3细胞均有效,IC 50 值分别为3.2ng/ml和4.3ng/ml。值得注意的是,在相同的实验条件下,游离DTX和非靶向SC-[DTX]NP制剂均不具有细胞毒性,这凸显了CNPs在模块化功能化后的强靶向作用。没有DTX的任何靶向纳米颗粒均未观察到毒性。
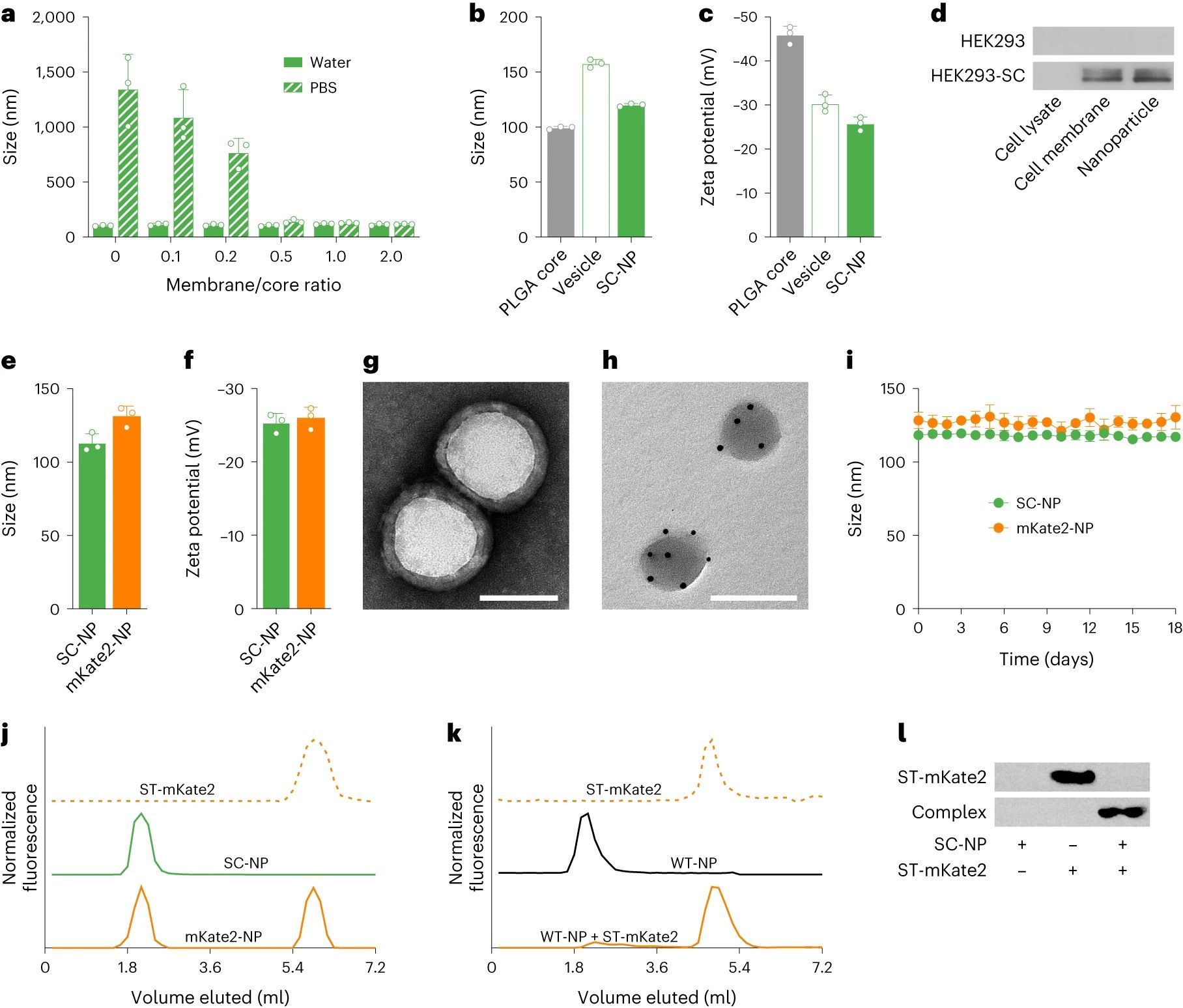
图3. 纳米颗粒合成和功能化
体内靶向、治疗效果和安全性
接下来使用肿瘤异种移植物在体内评估模块化功能化CNPs的性能。为了建立该模型,将裸鼠皮下植入SKOV3细胞。通过尾静脉静脉内静脉注射荧光标记的αEGFR-NP或αHER2-NPs,并在24小时内对动物进行活体成像。对于两种靶向制剂,在1小时内在肿瘤部位观察到强烈的荧光信号,然后随着时间的推移略有衰减。相比之下,观察到非靶向SC-NP制剂的荧光可以忽略不计。结果通过器官离体荧光成像及定量分析得到证实,其中仅对接受αEGFR-NPs或αHER2-NPs的小鼠再次观察到肿瘤中的强信号。在每个器官的基础上,纳米颗粒主要存在于肝脏中。使用负载DTX的纳米制剂针对相同的SKOV3模型评估治疗效果。一旦肿瘤大小达到平均70mm2,纳米颗粒每3天以每公斤(体重)3毫克的药物剂量静脉注射,总共四次给药。αEGFR-[DTX]NPs和αHER2-[DTX]NPs都能够控制肿瘤生长,而SC-[DTX]NPs的影响要小得多。在监测生存率时也观察到类似的趋势。SC-[DTX]NPs能够将中位生存期从治疗开始后24天延长至29天,而αEGFR-[DTX]NPs和αHER2-[DTX]NPs分别将中位生存期延长至63天和71天。为了进一步评估耐受性和潜在的脱靶副作用,将SC-NPs、SC-[DTX]NPs、αEGFR-[DTX]NPs和αHER2-[DTX]NPs按照与疗效研究相同的时间表给予免疫功能正常的小鼠,并在第一次注射后1天和10天收集样品进行分析。在血液化学检测中,接受载药纳米颗粒的小鼠的所有参数都与对照小鼠一致。在血细胞计数方面没有观察到差异,包括红细胞、血小板和白细胞。
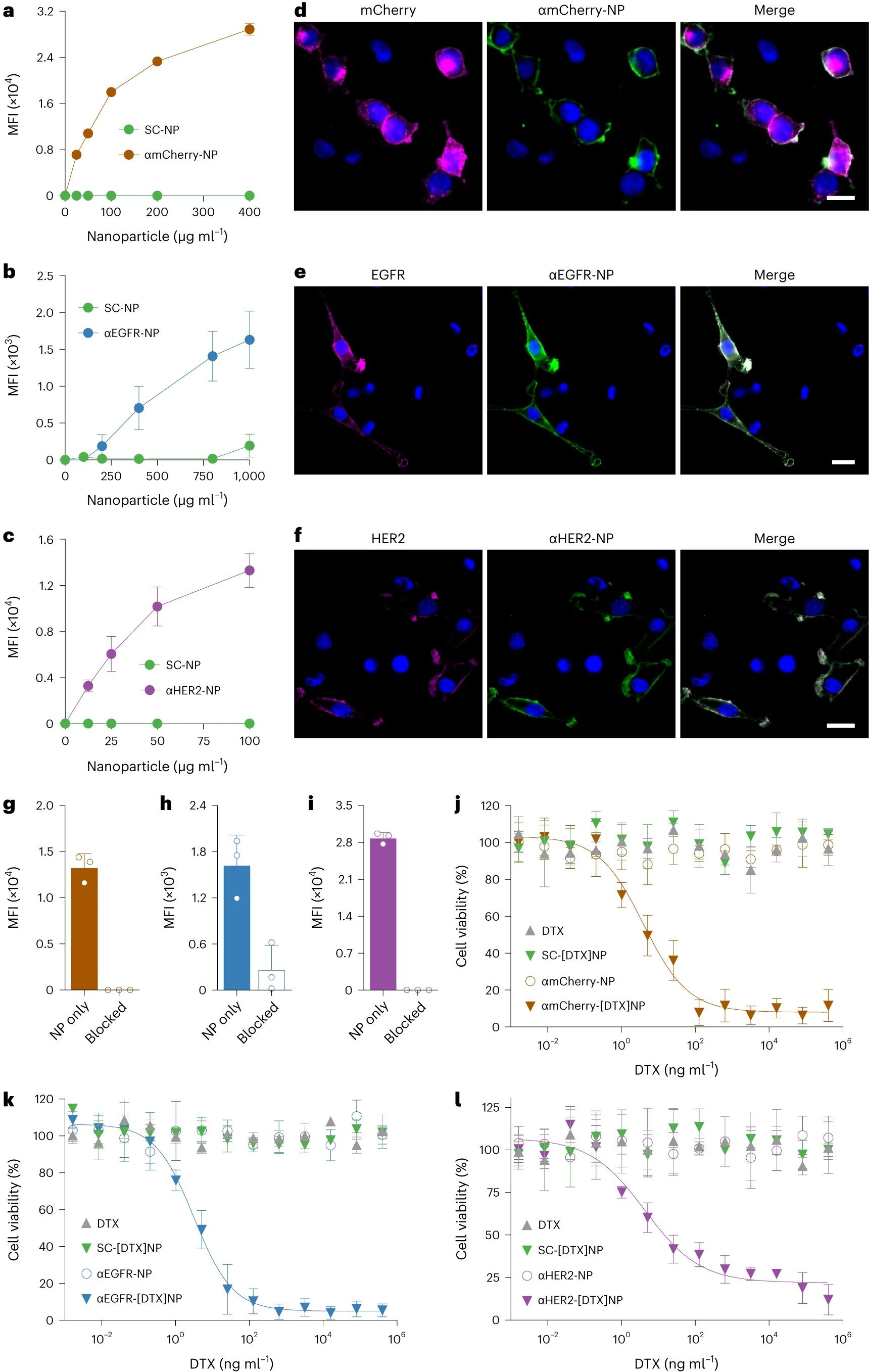
图4. 模块化功能化纳米颗粒的功能表征
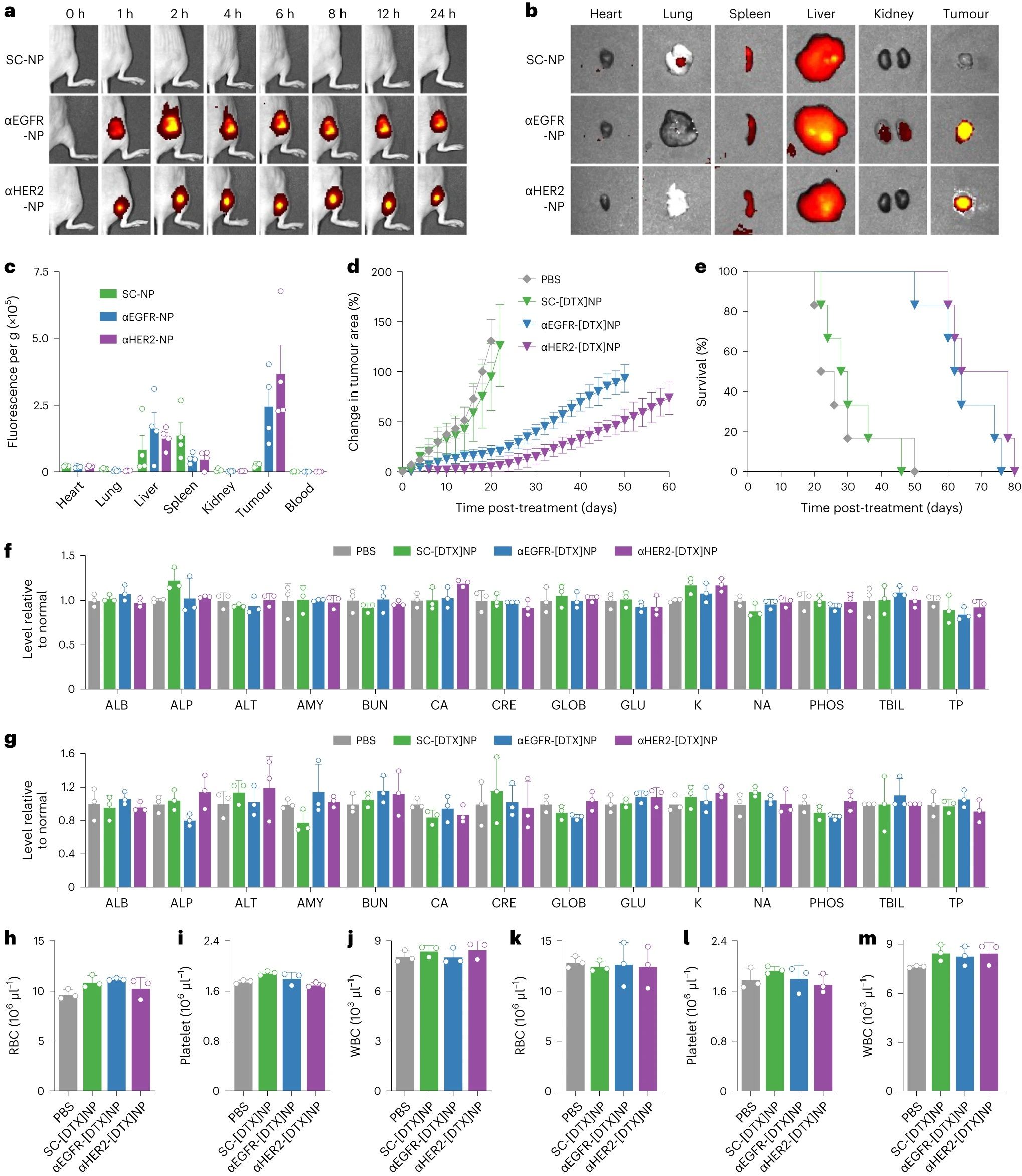
图5. 体内肿瘤靶向、治疗效果和安全性
综上所述,本文开发了一种CNPs平台,可以很容易地以模块化方式用可溶性配体进行修饰。使用相同的基础配方,可以将各种组件附着在纳米颗粒表面上,以引入新的功能。通过SpyCatcher-SpyTag结合尝试了各种类别的配体,包括荧光蛋白和三种不同的靶向组分,验证了该方法的广谱性。模块化功能化CNPs在体外和体内都表现出与表达相应同源受体的癌细胞的强结合,使得细胞毒性显着增强,从而抑制肿瘤的生长并延长小鼠模型的生存期。尽管目前的研究侧重于癌症治疗,但报告的方法应该很容易推广到其他疾病状况或治疗方式。
参考文献:
Krishnan, N., Jiang, Y., Zhou, J. et al. A modular approach to enhancing cell membrane-coated nanoparticle functionality using genetic engineering. Nat. Nanotechnol. 19, 345–353 (2024).