“文献精读系列”是脊柱脊髓损伤再生修复教育部重点实验室举办的常规科研交流学习会议,旨在聚焦领域内前沿进展,探究学术尖端技术研究路线,培养锻炼青年科研人员与硕博生科研思维。
【文献精读】会议日期:2024年3月5日 审校人:徐徐 报告人/撰稿人:庄心悦 编辑:宋思敏
阿尔茨海默病(AD)是痴呆症的主要原因,其发病率随着年龄的增长而迅速增加,但为何年龄成为主要危险因素仍知之甚少。阿尔兹海默病(AD)的病理特征主要包括新皮层和海马体中的Aβ斑块沉积和神经原纤维缠结。脑老化影响少突胶质细胞和髓鞘的结构完整性,后者与继发性神经炎症有关。髓鞘由髓鞘蛋白(CNP)、髓磷脂髓鞘蛋白(PLP)等组成,是包裹在神经细胞轴突外面的一层膜,具有轴突传导作用,其非致密区允许少突胶质细胞为神经元提供代谢支持。
2023年5月31日,德国马普所Klaus-Armin Nave研究团队在《Nature》期刊发表了题为 “Myelin dysfunction drives amyloid-β deposition in models of Alzheimer’s disease”的研究文章,揭示了髓鞘障碍引起轴突病变处淀粉样斑块形成,并可能通过减弱小胶质细胞对Aβ斑块的限制作用促进斑块形成,提示了改善少突胶质细胞功能和髓鞘完整性可能有助于延缓AD的发展和减缓疾病进程。

在先前的相关研究中,宏观的脑成像研究结果表明,AD患者的大脑皮质在AD的临床前阶段就已发生了髓鞘损伤。作者使用免疫荧光技术分析了一部分AD患者的皮质内髓鞘完整性,并重点分析跨内嗅区域,发现样本大脑皮层中的淀粉样斑块与小胶质细胞增多,髓鞘结构蛋白减少,说明AD患者皮质内髓鞘密度下降,并且这种下降并不局限于Aβ斑块附近(图1)。
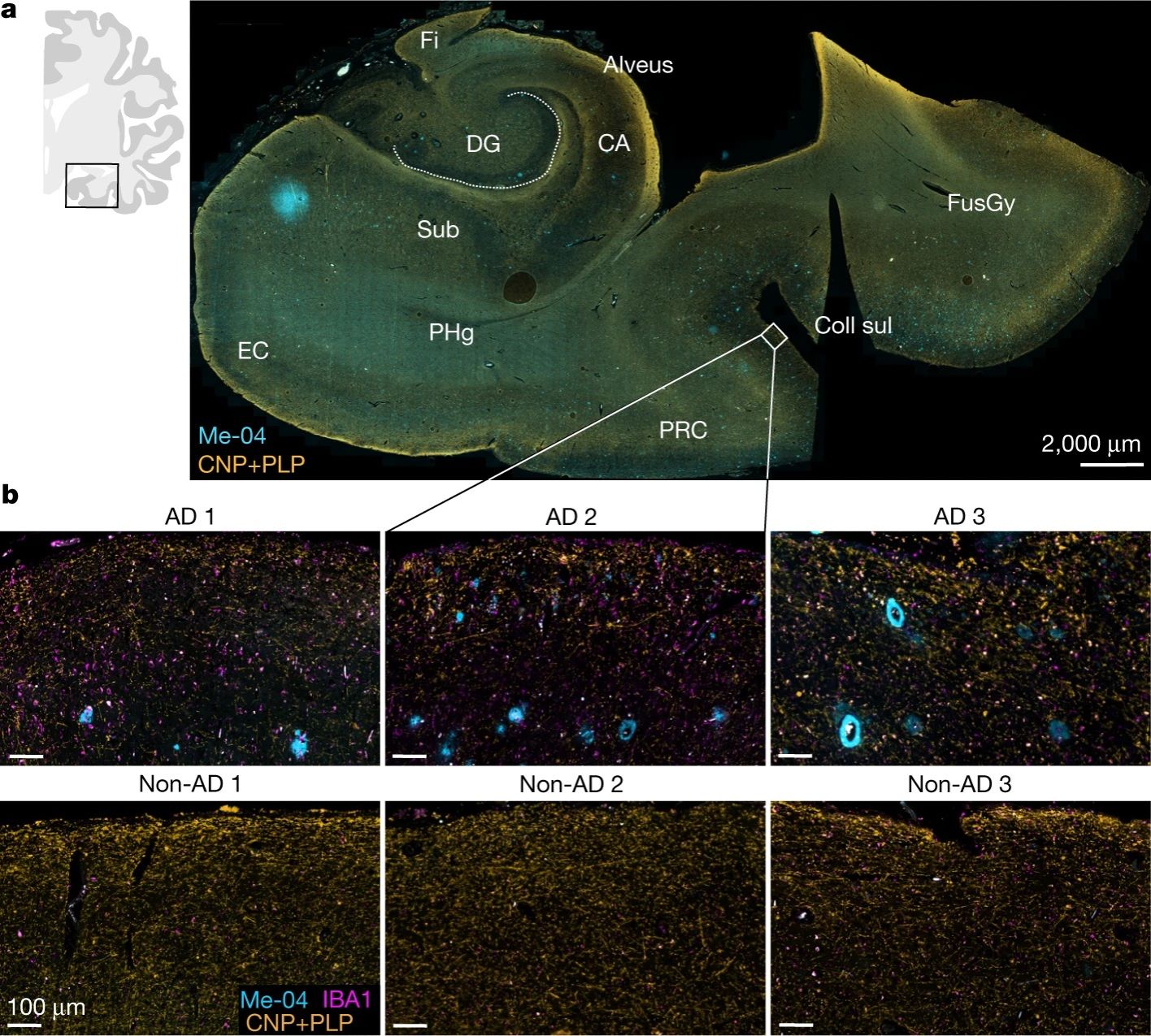
图1 AD患者的髓鞘损伤
为了确定这种与衰老相关的髓鞘缺陷是否会导致淀粉样蛋白沉积,作者将Cnp-/-和Plp-/y突变体小鼠与5×FAD小鼠杂交,得到了同时存在髓鞘病变与AD病变的模型小鼠。分析了所得后代的斑块沉积发现,与5×FAD小鼠相比,Cnp-/-;5×FAD小鼠和Plp-/y;5×FAD小鼠在6个月龄时海马白质(海马槽)和皮质中的淀粉样斑块负荷明显增加(图2a-d)。
为了证实髓鞘功能障碍是斑块病理的上游驱动因素,作者使用两种模型测试了急性脱髓鞘疾病对AD小鼠Aβ斑块沉积与AD病理的影响。第一种模型是cuprizone模型,cuprizone是一种铜螯合剂,可以通过掺杂在饲料中的给药形式诱导小鼠机型脱髓鞘。在进行四周的投药诱导与四周的恢复后,发现模型小鼠的内侧胼胝体和海马槽出现大量脱髓鞘,且小胶质细胞增多。用Aβ抗体对小鼠发生严重脱髓鞘脑区的Aβ斑块进行染色,发现淀粉样蛋白聚集体大量增加(图2e),表明cuprizone诱导的急性脱髓鞘会导致Aβ的快速沉积。
第二种急性脱髓鞘模型是实验性自身免疫性脑脊髓炎(EAE),造模方法是用髓鞘少突胶质细胞糖蛋白(MOG)肽幼年5×FAD小鼠进行免疫,并分析4周后的大脑和脊髓(图2f)。结果发现大脑中缺少淀粉样蛋白沉积,脊髓中脱髓鞘性病变显著,并在病变周围出现了小的非典型淀粉样蛋白聚集体(图2f)。
综上所述,慢性和急性的髓鞘缺陷驱动了AD小鼠模型中淀粉样蛋白沉积,表明髓鞘功能障碍是淀粉样蛋白沉积的上游风险因素。
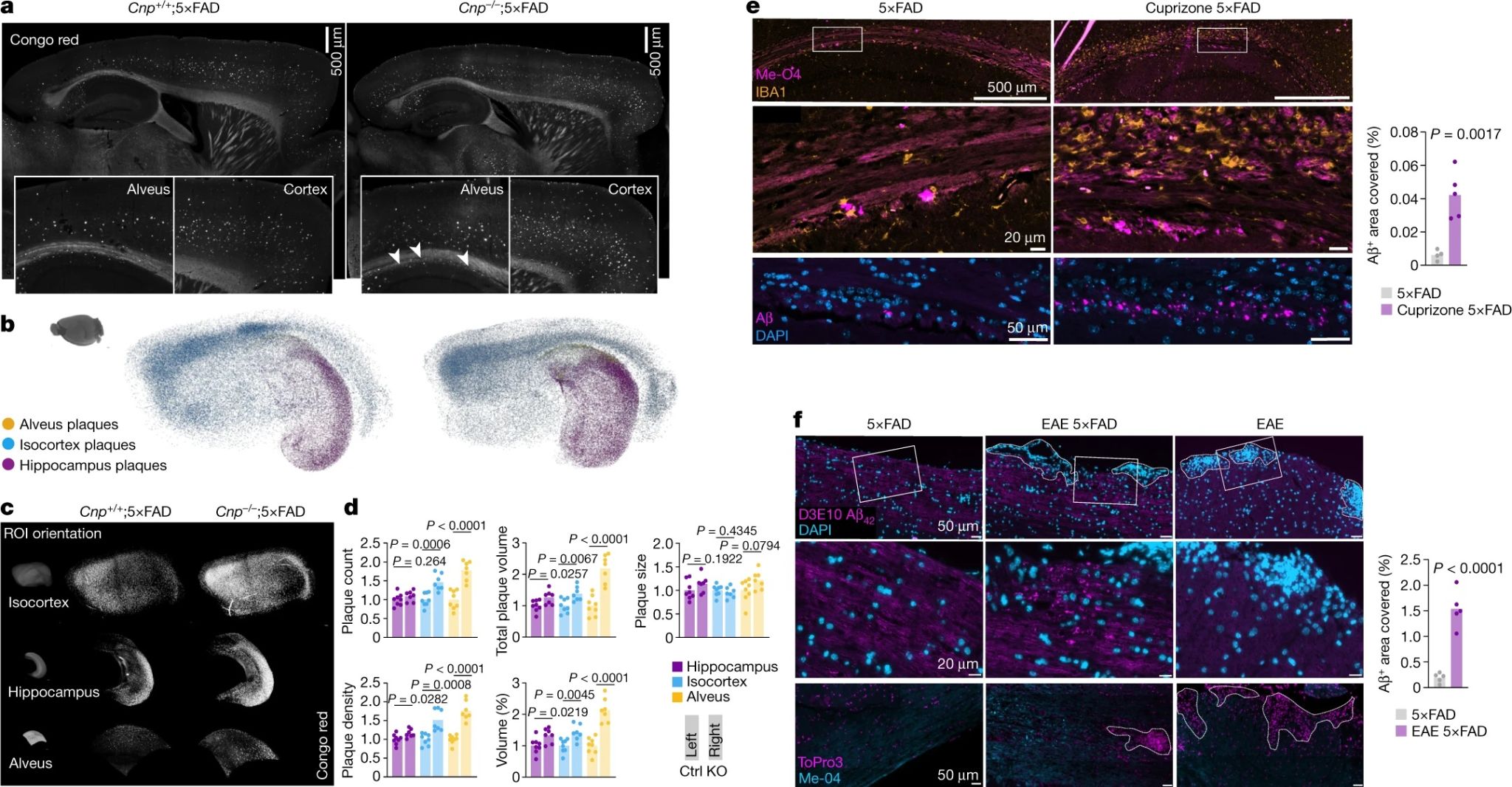
图2 髓鞘脱失和脱髓鞘会增强5×FAD小鼠淀粉样蛋白斑块的沉积
对于髓鞘缺陷促进淀粉样斑块沉积的机制,研究人员提出了两种可能,一是可能通过促进淀粉样前体蛋白(APP)的加工和β/γ裂解酶的过度剪切导致斑块增加,二是可能通过干扰Aβ的去除阻止斑块减少。
首先,研究人员针对第一种猜想展开了相关研究。高压冷冻电镜分析显示,髓鞘损伤相关的肿胀富含囊泡结构,其可能由内质体或溶酶体构成(图3a)。通过对APP与Aβ,以及APP剪切酶进行免疫荧光染色,研究人员发现,Cnp-/-;5×FAD小鼠大脑的轴突肿胀处APP片段和BACE1的表达升高,并且其与β-裂解酶和γ-裂解酶的染色结果共定位,说明髓鞘损伤也会导致肿胀处β-裂解酶和γ-裂解酶的积累(图3b-e)。此外,对白质和皮质进行的蛋白质印记分析结果显示,6个月大的Cnp-/-;5×FAD小鼠的大脑白质与皮质中BACE1的水平显著升高(图3f),同时皮质中APP羧基末端片段(CTF)的丰度增加,但全长APP蛋白的丰度以及α/β CTF的比值无变化(图3g),作者推测这种现象可能是由于白质神经元细胞中的CTF向大脑皮层的逆向运输所致。综上所述,髓鞘功能障碍会影响APP代谢,促进APP的表达以及Aβ的生成。
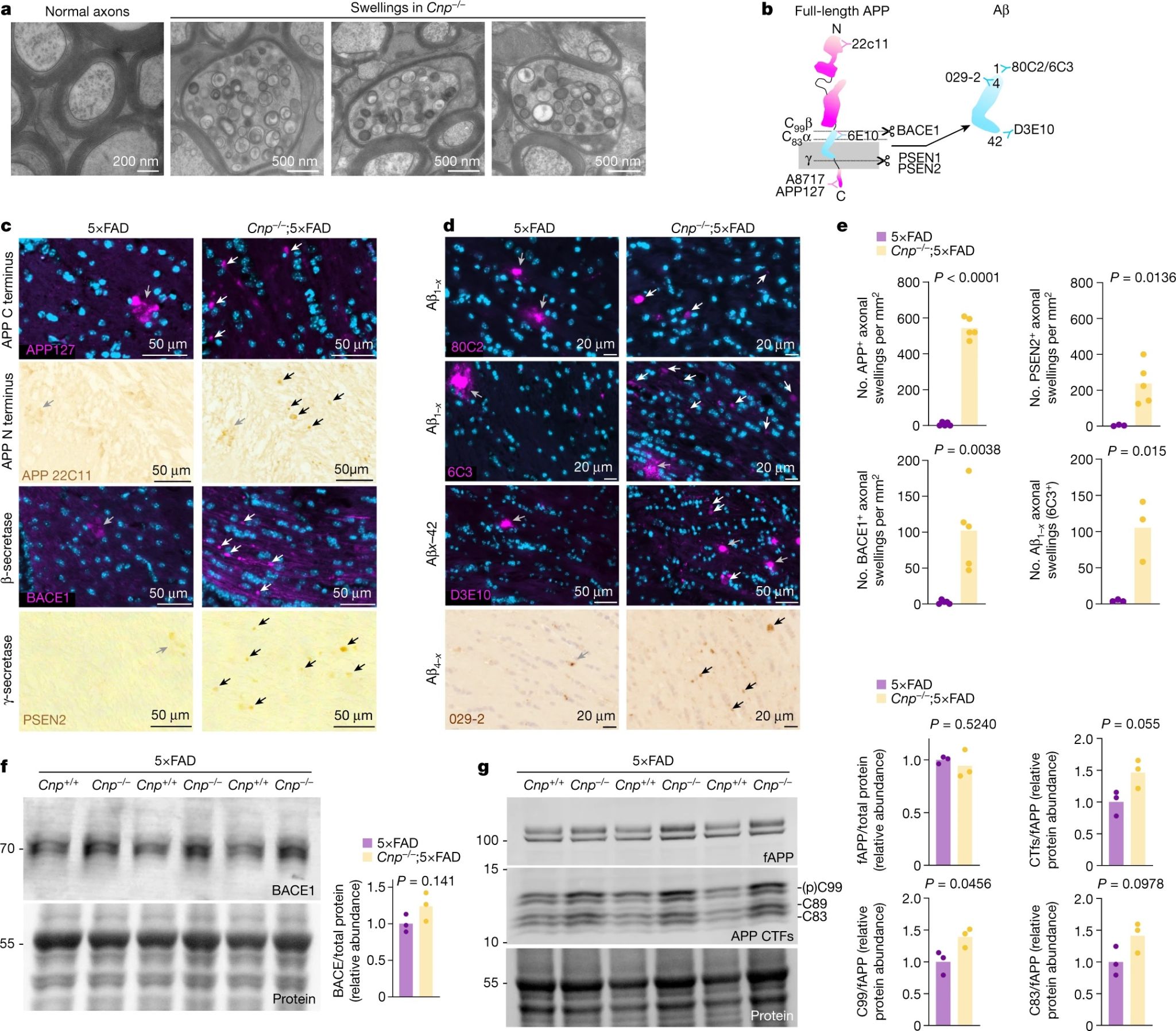
图3 髓鞘功能障碍改变APP加工
神经胶质细胞在髓鞘碎片和淀粉样肽的清除中发挥重要作用,其中小胶质细胞在淀粉样斑块周围形成屏障,限制斑块的进一步沉积并清除斑块。研究人员发现,在体内,尽管Cnp-/-;5×FAD 小鼠和 Plp-/y;5×FAD 小鼠中白质和灰质的小胶质细胞数量都大幅增加,但小胶质细胞未能聚集在淀粉样斑块周围(图4a-b)。
作者研究了髓鞘功能障碍是否干扰Trem2的上调以及与斑块聚集表型相关的疾病相关小胶质细胞(DAM)信号的诱导。为此,作者对小胶质细胞进行了磁激活细胞分选(MACS)和批量RNA测序(RNA-seq)(图4c)。主成分分析(PCA) 和差异基因表达分析显示,在整个WT、5×FAD、CNP-/-和CNP-/-;5×FAD中,小胶质细胞稳态标记物逐渐下调(图4d)。经典DAM特征基因在5×FAD小鼠的小胶质细胞中上调,并且在Cnp-/-小鼠和Cnp-/-;5×FAD小鼠的小胶质细胞中进一步增加(图4e,f)。其中,DAM 特征基因(Clec7a、Gpnmb、Apoe、Spp1、Axl 和 Itgax)和 Ms4a 簇基因在 Cnp-/-;5×FAD 小鼠中高度上调,这是高吞噬性小胶质细胞的特征。然而,Trem2 和 Tyrobp 的mRNA水平未发生改变(图4f)。免疫共染色结果也表明,Cnp-/-;5×FAD小鼠中出现了Aβ聚集,小胶质细胞增多和APOE水平增加(图4g, h)。
为了更好地了解髓鞘缺陷诱导的DAM样小胶质细胞的特征,作者进一步对Cnp-/-;5×FAD小鼠和各自对照的脑组织进行了单核RNA-seq(snRNA-seq)(图5a)。聚类分析确定了五个主要的小胶质细胞和巨噬细胞亚群,包括两个不同的具有DAM标记基因高表达的簇(图5b-d)。簇4几乎完全来源于具有5×FAD基因型的细胞,因此被称为淀粉样蛋白DAM,而簇5主要由具有Cnp-/-突变的细胞组成,因此被称为髓鞘DAM(图5e)。髓鞘DAM和淀粉样蛋白DAM之间的差异表达分析显示,在髓鞘DAM中脂质代谢相关基因(Apoe、Abca1和Apobec1)和Ms4a簇的基因上调(图5f),而淀粉样蛋白DAM中特异性上调的基因包括Cst3、Ctna3和Gpc5,尽管检出率较低,但Cst7也特异性富集于淀粉样蛋白DAM中(图5g)。
总体而言,单核转录组分析表明,小胶质细胞对髓鞘功能障碍和淀粉样斑块具有类似但不同的响应方式。在CNP-/-;5×FAD模型中两种病理共存,两种小胶质细胞亚型都被充分诱导,然而免疫荧光的实验结果显示斑块周围聚集的小胶质细胞几乎完全消失。
为了解释这一现象,作者假设髓鞘损伤导致小胶质细胞远离淀粉样蛋白斑块。免疫染色的结果表明,Cnp-/-;5×FAD小鼠中的大量小胶质细胞和斑块相关的小胶质细胞反应性地参与髓鞘吞噬作用(图5h)。Cst7 原位杂交(淀粉样蛋白-DAM 的标记)的结果显示,Cnp-/-;5×FAD 小鼠中的淀粉样蛋白-DAM 出现在斑块的远端(图5i)。作者推测,髓鞘损伤会使很大一部分小胶质细胞参与髓鞘清除,并诱导淀粉样蛋白DAM远离斑块,从而导致大脑中淀粉样蛋白沉积的更快形成。此外,由激活的髓鞘DAM分泌的细胞因子(如APOE)可能进一步促进斑块的形成。
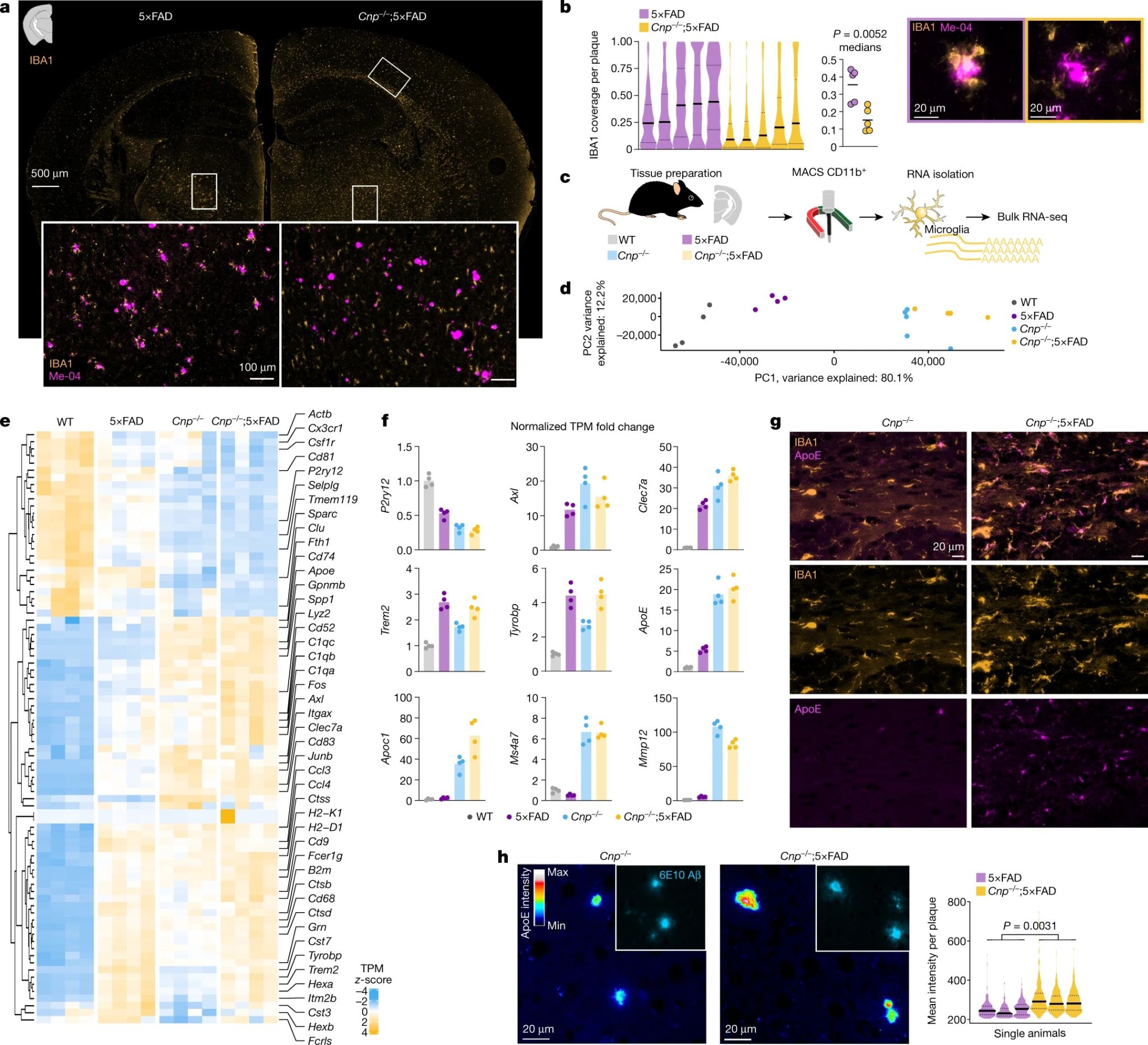
图4 髓鞘突变小鼠淀粉样斑块周围小胶质细胞的丧失
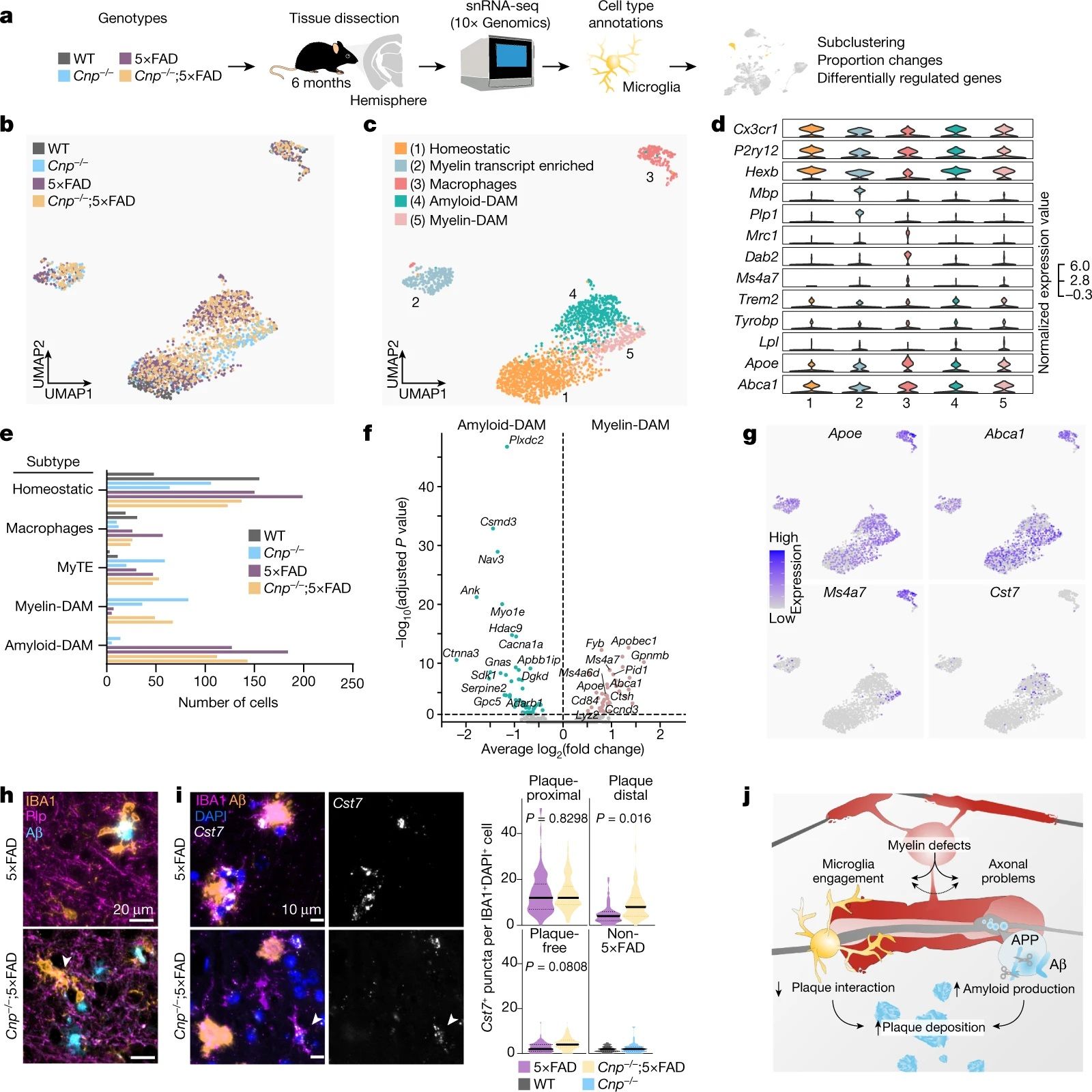
图5 snRNA-seq 确定髓鞘功能障碍会诱导与淀粉样蛋白沉积不同的DAM样状态
基于前文中的实验结论,作者提出了一个AD的工作模型(图5j),该模型中老化前脑中的髓鞘功能障碍干扰了小胶质细胞清除Aβ沉积和防止斑块形成。同时,老化的髓鞘失去其轴突支持功能导致轴突受损,并最终诱导BACE1和APP CTF水平上升,使Aβ生成增强。作者的这些研究发现说明,与年龄相关的髓鞘完整性丧失可能是淀粉样蛋白沉积的上游驱动因素。
参考文献:
Depp, C., Sun, T., Sasmita, A.O. et al. Myelin dysfunction drives amyloid-β deposition in models of Alzheimer’s disease. Nature 618, 349–357 (2023).