“文献精读系列”是脊柱脊髓损伤再生修复教育部重点实验室举办的常规科研交流学习会议,旨在聚焦领域内前沿进展,探究学术尖端技术研究路线,培养锻炼青年科研人员与硕博生科研思维。
【文献精读·】会议日期:2023年04月24日 审校人:林古法 报告人:解婧媛
小胶质细胞是大脑中的常驻巨噬细胞,它可以通过清除死亡的神经元、修剪非功能性的突触和产生支持神经元存活的配体来帮助调节大脑功能,在大脑发育和维持神经元功能中发挥着不可忽视的作用。在中枢神经系统中,小胶质细胞和神经元之间存在细胞通讯。
载脂蛋白E(APOE)是一类糖蛋白,参与脂质代谢调控,在中枢神经系统中广泛表达于星形胶质细胞、小胶质细胞、血管壁细胞以及脉络丛细胞。APOE有三个等位基因异形体,分别是APOEε2、APOE ε3和APOEε4。APOE是晚发型阿尔兹海默病(AD)的主要风险因子,其中APOEε2对AD有保护作用,APOEε4会增强AD发病风险,APOEε3属于中性等位基因,与AD无关。
2022年8月4日麻省理工学院 Picower学习与记忆研究所Li-Huei Tsai教授团队在 Cell Stem Cell 发表论文“Lipid accumulation induced by APOE4 impairs microglial surveillance of neuronal-network activity”,利用iPSCs来源的神经元和小胶质细胞揭示了APOE4 诱导的脂质聚集会影响小胶质细胞和神经元之间的双向交流。

在大脑内,嘌呤能受体P2RY12在小胶质细胞中高度表达,使之能够感知细胞外的ADP或ATP。许多神经元分泌的可溶性因子维持小胶质细胞处于活跃监测状态。而小胶质细胞也表达许多神经递质受体。为了了解来源于iPSC的小胶质细胞是否具有表达介导神经元-小胶质细胞通讯的受体,本文研究人员首先诱导构建了人类小胶质细胞样细胞(iMGL),发现iMGL再现了控制神经元活动监测的受体的表达模式,而且能感知分泌型的神经元可溶性因子,如核苷酸或神经递质,通过构建前脑球体也验证了iMGL能够对更具生理性的神经元刺激作出反应。
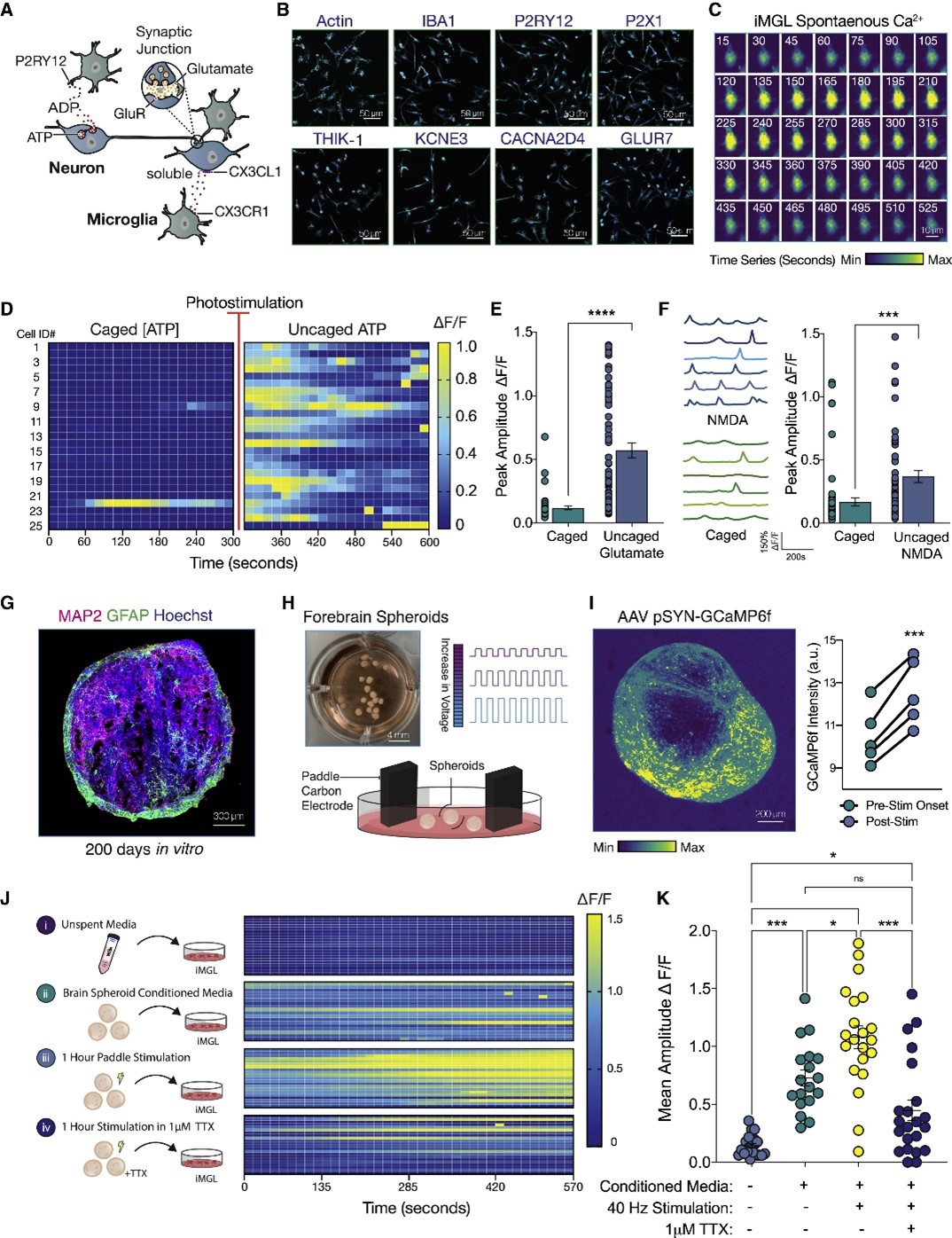
图1 神经元活动诱发iPSC衍生的小胶质细胞中的Ca2+瞬变
高水平的神经元活动与体内大量的小胶质细胞钙瞬变有关,为了确定APOE4对神经元-小胶质细胞交流的功能影响,本文研究人员首先将APOE3球状体的条件培养基(CM)应用于APOE3或APOE4 iMGL单一培养,同时观察其钙瞬变。结果发现神经元CM在APOE4 iMGL中诱发的钙瞬变低于APOE3 iMGL。随后将针对各种类别的信号通路的选择性抑制剂联合应用于APOE3 iMGL后,研究人员发现在APOE4 iMGL中,嘌呤能信号通路受损。考虑到嘌呤能受体P2RY12的下调与小胶质细胞的激活状态有关,这个结果提示APOE4 iMGL的稳态监测状态发生了改变。
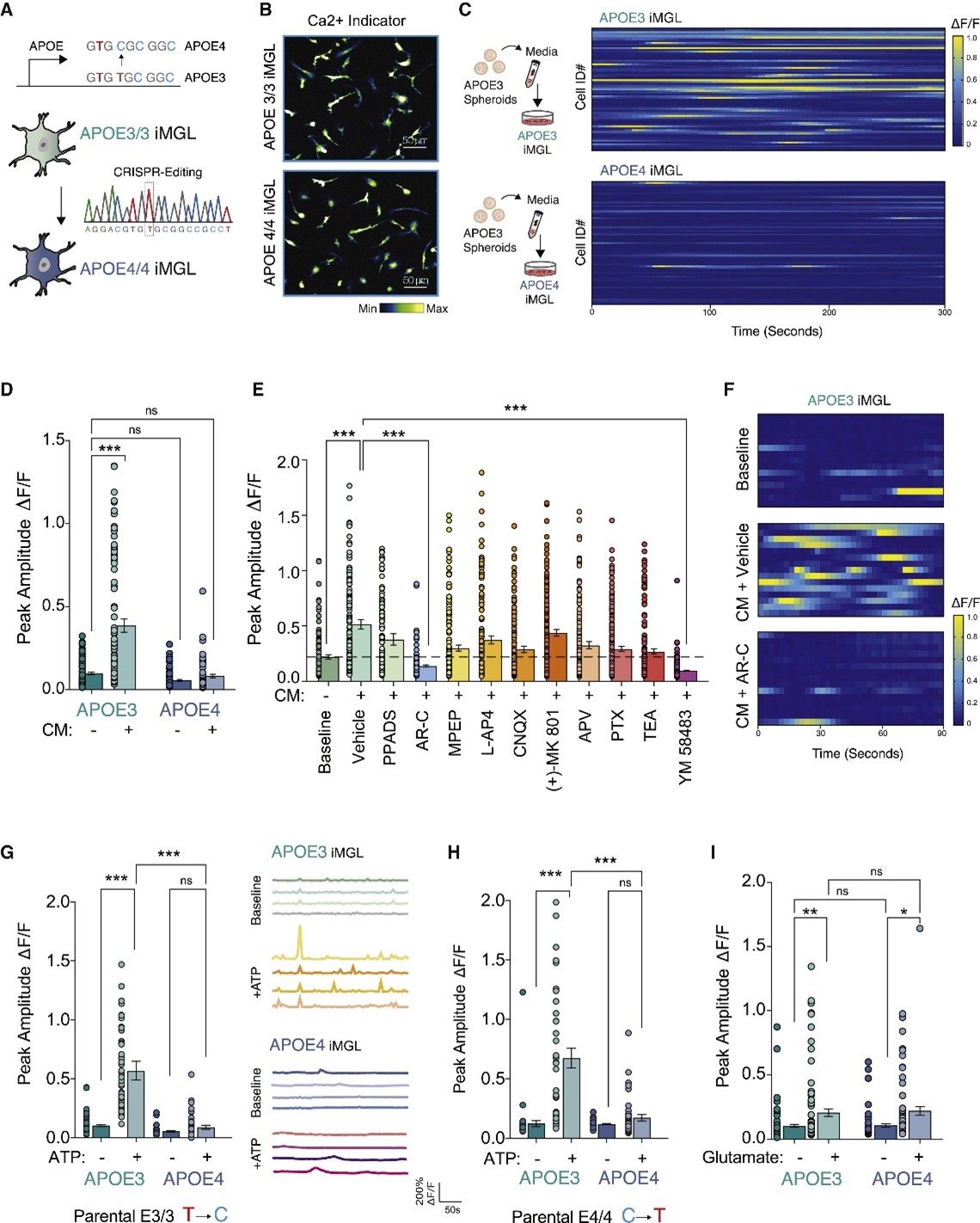
图2 APOE4 iMGL对神经元产生的ATP适应性较弱
研究人员进一步地对APOE3 iMGL、APOE4 iMGL以及两者在CM中培养的细胞(+CM)的转录谱进行分析。结果显示,神经元条件培养基在APOE3和APOE4 iMGL中会引起不同的转录反应。例如,在APOE3 iMGL+CM中观察到炎症抑制因子的诱导,但APOE4 iMGL+CM所特有的转录因子与促进炎症发生的或由促炎症刺激诱导而来的巨噬细胞有关,这表明在APOE4 iMGL中该免疫检查点未被监测,从而可能导致下游免疫效应因子过度激活。与此同时,分析结果还显示,APOE4在小胶质细胞中的表达诱导了与促炎症状态相关的能量产生的代谢重编程。有趣的是,在暴露于神经元CM后,研究人员进一步检测到APOE4 iMGL中涉及脂质从头合成或调节其细胞储存的一个基因集的差异上调,其中酰基辅酶A合成酶ACSL1表现出最强烈的富集。随后的实验也证实,与APOE3 iMGL相比,APOE4 iMGL中的脂滴含量显著增加,而Ca2+动员可能是这背后调节的关键组成部分。
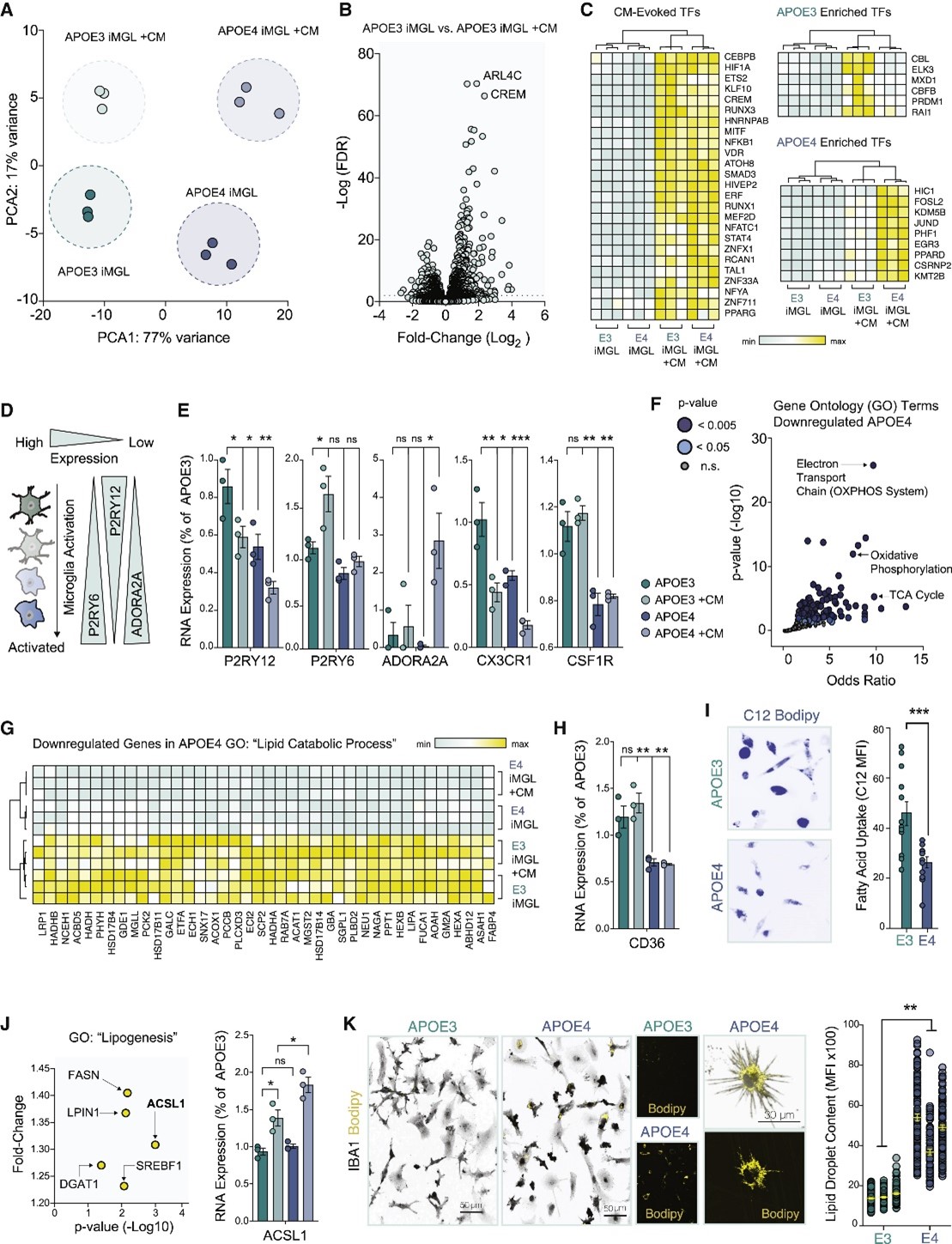
图3 APOE4使iMGL转变为一种脂质分解功能受损的细胞状态
接下来,研究人员又评估了APOE4 iMGL对神经元活性的影响。结果显示,APOE4 iMGL降低了APOE3球状体培养物中钙瞬变水平,破坏APOE3神经元的协调性集群事件,但是并没有影响突触的大小或数量,由此提 APOE4 iMGL对神经元网络动态变化的负面影响并不是通过吞噬机制(修剪突触)介导的。随后,研究人员将APOE3或APOE4 iMGL单一培养的培养基用于APOE3球状体培养,结果显示APOE4 iMGL CM造成了神经元钙瞬变的显著减少。实验发现APOE4 iMGL培养物的上清液中富含APOE和胆固醇,而这一细胞外脂质积聚的现象是由于脂质内流缺陷造成的,APOE4 iMGL中脂质净流量失衡。
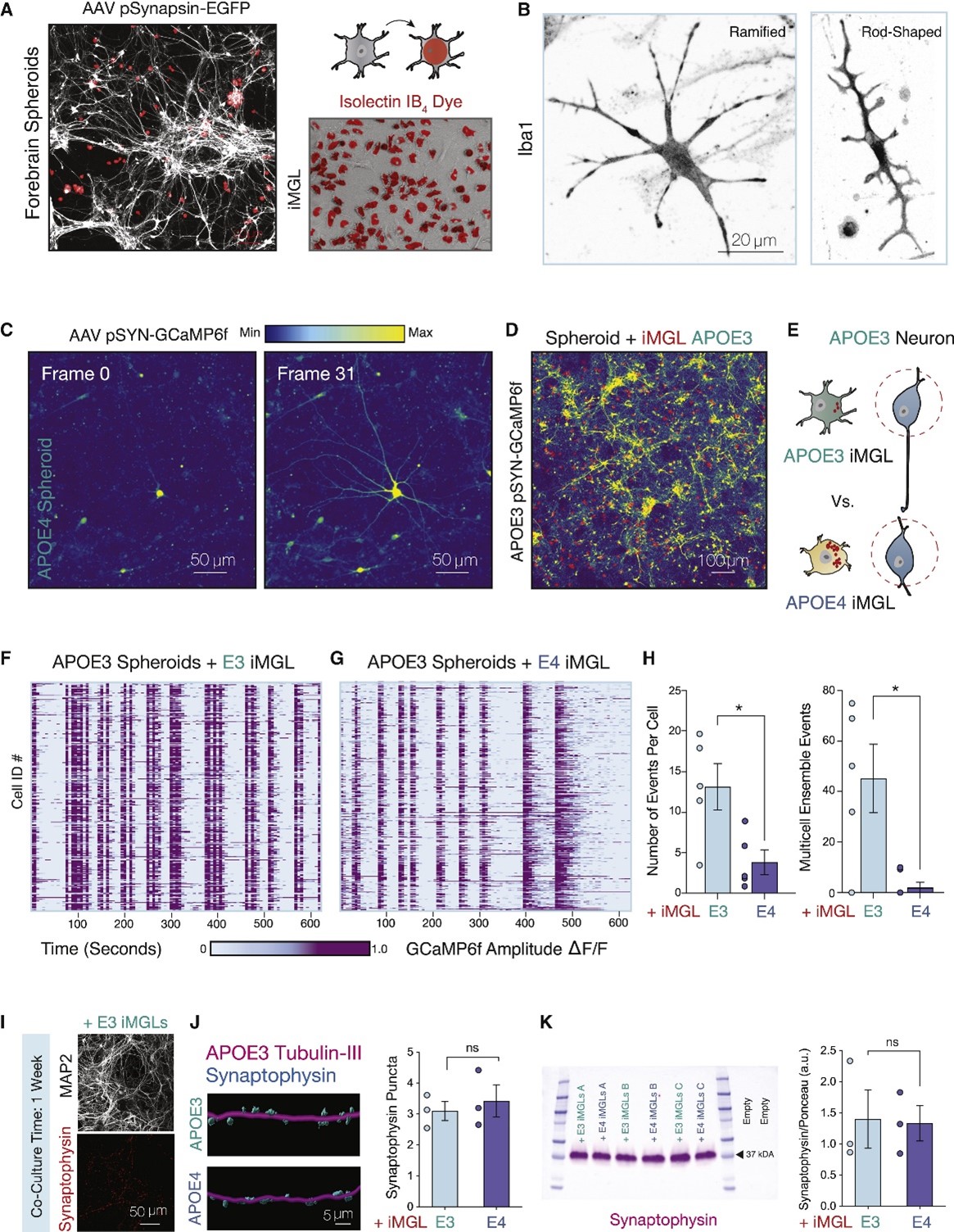
图4 APOE4 iMGL破坏了神经元集合体的同步活动
胆固醇对于正常的神经生理学是必不可少的,胆固醇的消耗会损害神经传递,但是胆固醇的增加又会促进淀粉样蛋白形成。本文研究人员发现外源性胆固醇可显著超极化神经元的静息膜电位(RMP),且内向整流钾(Kir)电流增大(强烈的Kir电流会超极化RMP并降低神经元兴奋性)。进一步的RNA测序分析显示APOE4 iMGL CM可显著上调APOE3球状体中GIRK3(一种G蛋白门控的内向整流K+通道Kir3.3)的转录水平,且增加神经元中的脂筏(GIRK通道定位于神经元膜上富含胆固醇的脂筏),并且其对于抑制APOE4 iMGL CM处理的神经元的神经元活性是必需的。由此证明细胞外胆固醇的积累(至少部分由于APOE4 iMGL对脂质的不良再摄取)可以通过增强GIRK电流抑制神经元活性。
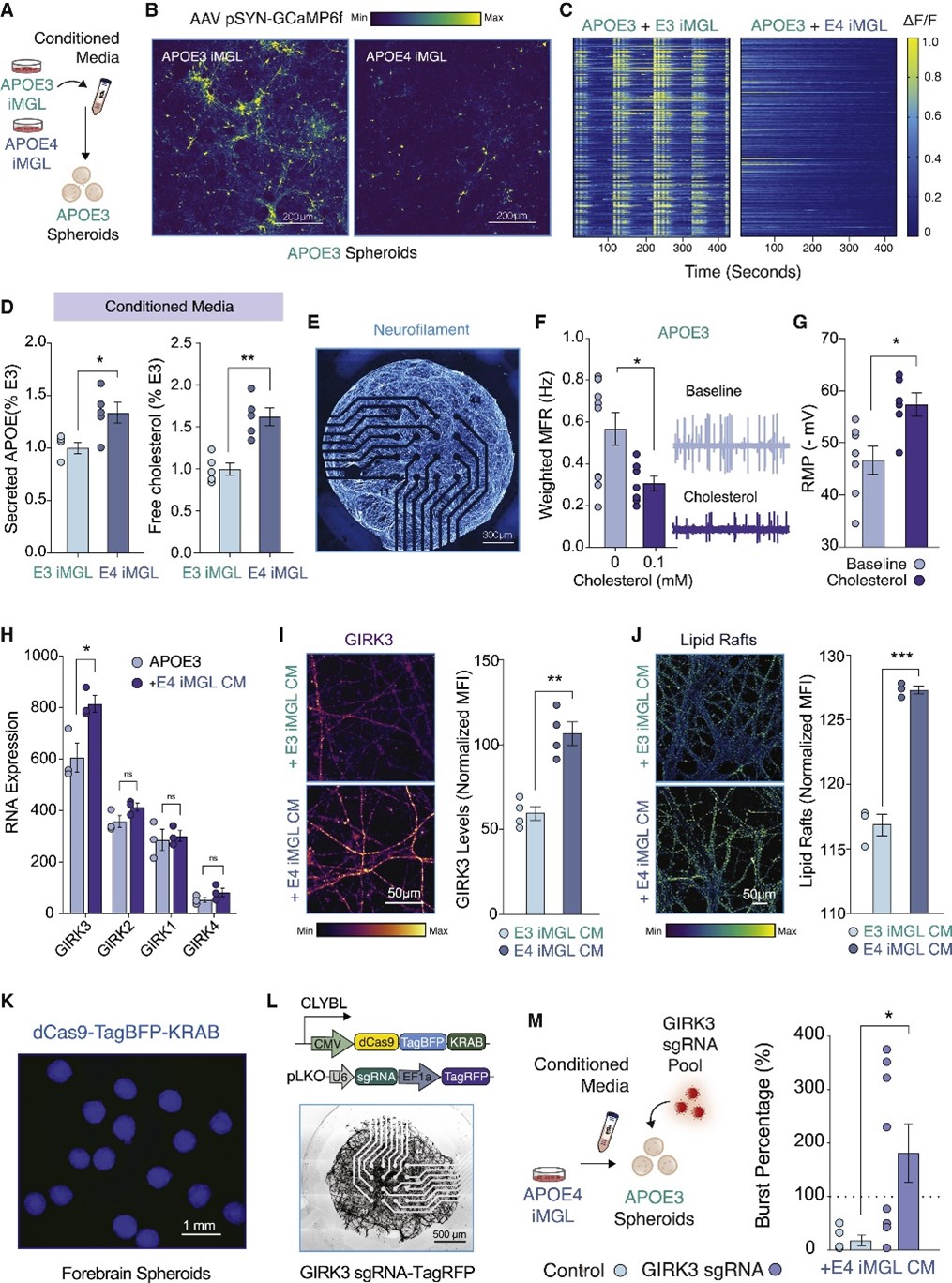
图5 APOE4 iMGLs 的条件培养基可以通过增强神经元脂质门控K +电流来破坏神经元活动
研究人员随后利用双向调节iMGL的脂质含量证实,增加脂质积累足以使小胶质细胞脱离稳态监测,表现出类似APOE4 iMGL状态的表型,而抑制脂质积累可以恢复APOE4 iMGL中的嘌呤能信号,其培养基中胆固醇积累减少,减轻了对神经元活性的抑制。由此表明,维持小胶质细胞内脂质稳态可以维持正常神经元网络功能所需的受监督稳态。
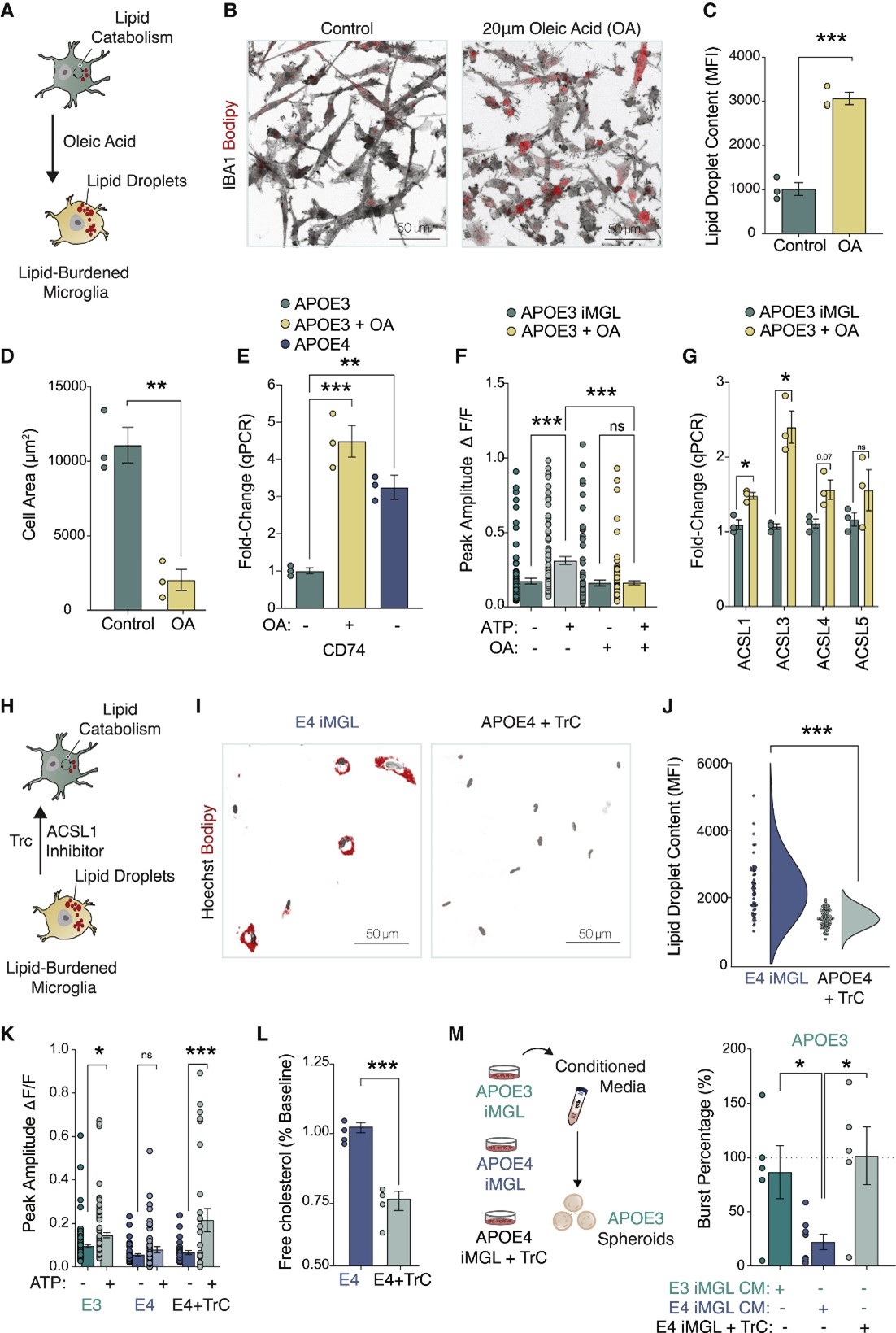
图6 双向操纵脂质含量可逆性驱动iMGLs中的嘌呤信号传导
总之,该研究发现APOE4破坏了小胶质细胞的脂质代谢能力,造成胞外胆固醇积累,进而干扰其与附近神经元相互交流的能力。
参考文献:Victor MB, Leary N, Luna X, Meharena HS, Scannail AN, Bozzelli PL, Samaan G, Murdock MH, von Maydell D, Effenberger AH, Cerit O, Wen HL, Liu L, Welch G, Bonner M, Tsai LH. Lipid accumulation induced by APOE4 impairs microglial surveillance of neuronal-network activity. Cell Stem Cell. 2022 Aug 4;29(8):1197-1212.e8.