“文献精读系列”是脊柱脊髓损伤再生修复教育部重点实验室举办的常规科研交流学习会议,旨在聚焦领域内前沿进展,探究学术尖端技术研究路线,培养锻炼青年科研人员与硕博生科研思维。
【文献精读】会议日期:2023年4月10日 审校人:林古法 报告人:陈洋
帕金森病是第二常见的神经退行性疾病,其主要症状包括运动迟缓、僵硬、静止性震颤和伴姿势不稳的步态障碍。黑质致密部(SNC)多巴胺神经元的变性是其主要病因。脑深部刺激(DBS)被认为是缓解帕金森症状的有效临床治疗方法之一。DBS通常通过长期植入电极电刺激神经系统来实现,但电极的植入往往会带来感染、炎症等副作用。因此,临床治疗上迫切需要一种按需、非侵入性、无线的DBS策略。
2022年12月1日,韩国浦项科技大学(POSTECH)Chulhong Kim教授和Won Jong Kim教授团队在 Nature Biomedical Engineering 上发表论文“Deep brain stimulation by blood–brain-barrier-crossing piezoelectric nanoparticles generating current and nitric oxide under focused ultrasound”,报道了一种在超声诱导下能够产生NO和电刺激的纳米颗粒,缓解了动物模型中的帕金森病症状。

作者构建了由聚多巴胺(pDA)包覆的压电钛酸钡纳米颗粒(BNTP)和N,N‘-二仲丁基-N,N’-二亚硝基-1,4-苯二胺(BNN6)结合的多功能纳米颗粒。该体系在高强度聚集超声(HIFU)下能够释放NO,促进血脑屏障的开放,使得BNTP-pDA能够在脑中聚集,再次给予HIFU时,BNTP-pDA会产生电流诱导电压门控的Ca2+通道开放,进而促进神经元释放神经递质。
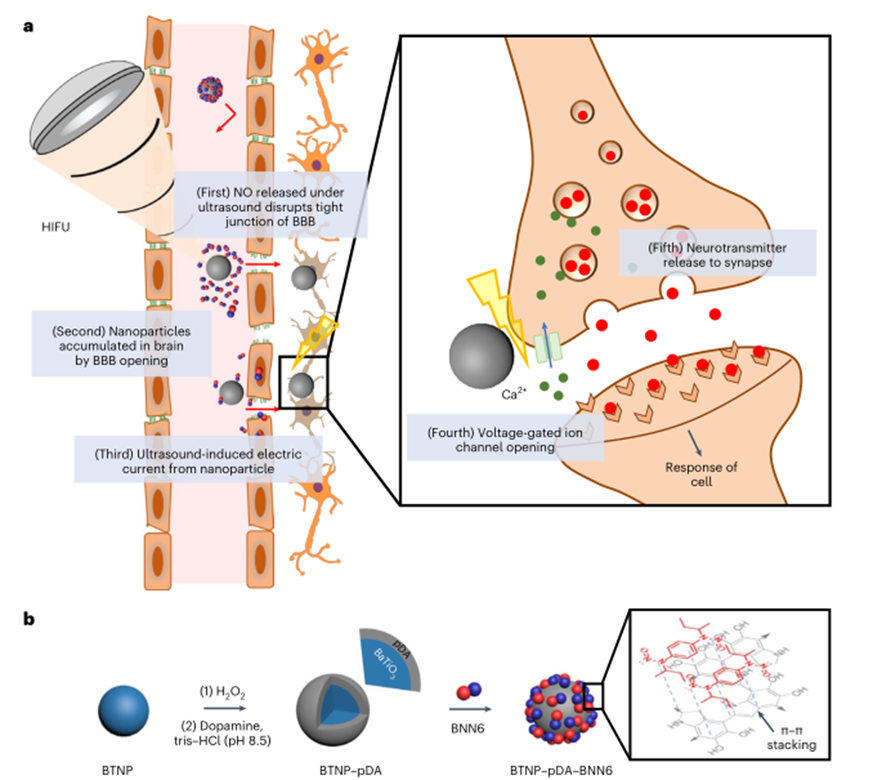
图1 超声响应型NO释放压电纳米颗粒
作者通过X射线光电子能谱(XPS)和傅立叶变换红外光谱(FTIR)证实成功地制备了PDA包覆的BTNP,且BNN6已成功负载到BTNP-PDA表面。热重分析(TGA)表明,PDA和BNN6的质量分数分别为7.64wt%和4.61wt%。生成的纳米粒子在水中均匀分布,即使在血清存在的情况下,其尺寸分布也保持不变。经过表面修饰后,在2θ≈45°(其中θ是X射线入射光束与晶体反射面之间的夹角)处保留了两个明显但接近的峰,证实了产生压电性的四方性守恒。通过研究纳米粒子在生理条件下超声响应NO的释放量分布,与没有超声时相比,在超声作用下释放出更多的NO。
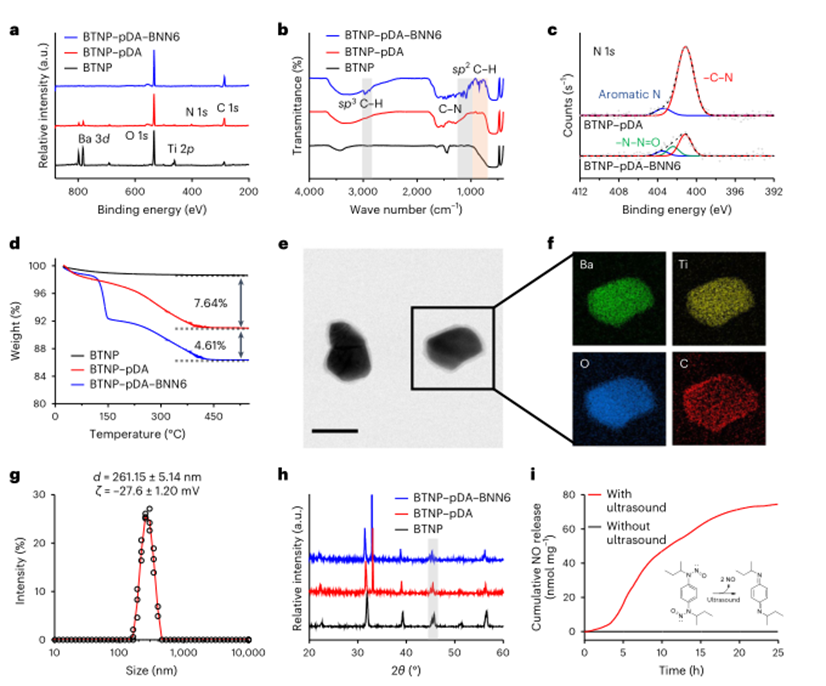
图2 纳米颗粒的表征
利用无互连膜片钳装置来监测BTNP-PDA在生理条件下的超声响应压电行为,在BTNP-PDA存在下,电流尖峰的强度与超声强度成正比。通过监测SH-SY5Y来源的神经元样细胞的钙动态变化研究了超声驱动的体外压电神经刺激,发现在超声和纳米颗粒共同处理神经元样细胞时,相比于其他对照组,细胞内钙离子浓度显著增加。通过定量细胞外多巴胺浓度来观察钙离子内流介导的神经递质释放,发现当使用超声和纳米颗粒联合处理时,培养液中的多巴胺浓度显著增加。综上,超声驱动纳米颗粒产生的电流输出通过打开电压门控的钙通道来促进神经刺激,随后释放神经递质。
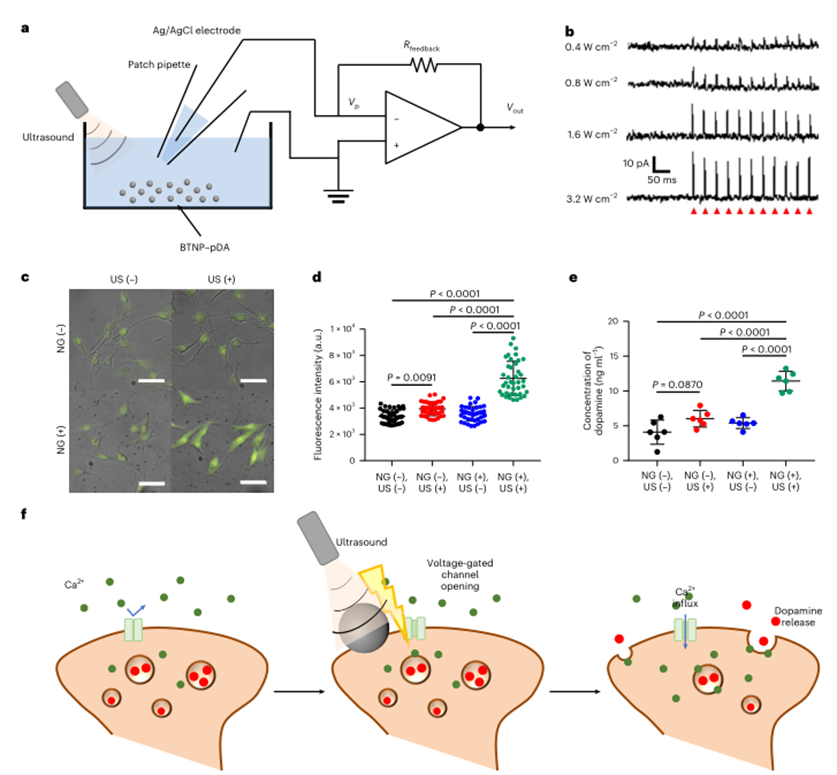
图3 体外压电神经刺激
为了研究释放的NO是否增强了纳米颗粒通过血脑屏障开口的运输,作者将纳米颗粒注射到小鼠体内,然后应用HIFU。通过使用超声成像系统监测,实时超声引导使HIFU聚焦于目标部位。在注射纳米颗粒后,应用HIFU 2h后,用TEM观察纳米粒子在小鼠脑组织中的蓄积。结果显示,与对照组相比,接受纳米颗粒和HIFU治疗的小鼠大脑中积累的纳米颗粒数量显著增加,表明NO对纳米颗粒进入大脑具有关键作用。
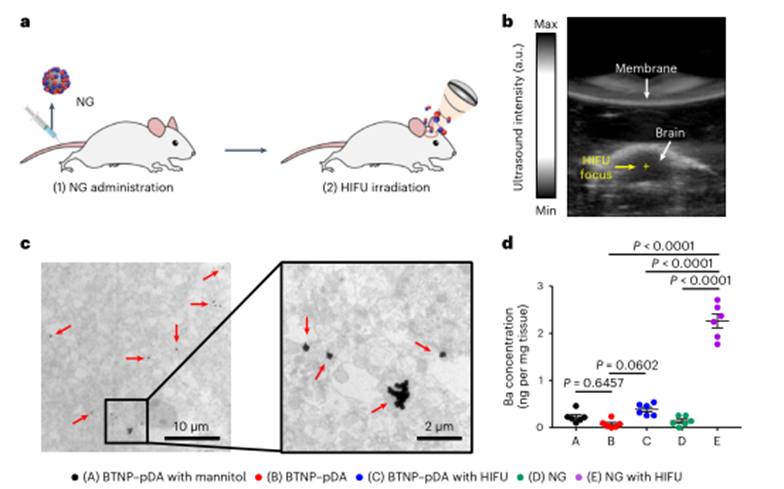
图4 纳米粒子在脑组织中的蓄积
在体外实验中,已知基质金属蛋白酶9(MMP-9)的水平受NO的调节,并且其可调节紧密连接蛋白(ZO-1),在血脑屏障的物质运输中发挥关键作用。当纳米颗粒和HIFU处理小鼠2h后,ZO-1的表达水平显著降低,MMP-9的表达水平显著增加。MMP-9的活性在纳米颗粒和HIFU处理后先上升后下降,表明NO对于MMP-9的激活是暂时性的。并且,与内皮细胞标记CD31共定位的ZO-1,在纳米颗粒和HIFU治疗后小鼠中脑切片的免疫荧光信号减少,揭示了ZO-1被破坏。当纳米颗粒和HIFU应用后0 min、60 min注射染料EB,观察到其明显地在大脑中积累,而2h后注射EB时,没有观察到EB在大脑中的积累。这些结果表明,NO介导的血脑屏障开放是暂时的,而不是永久性的。
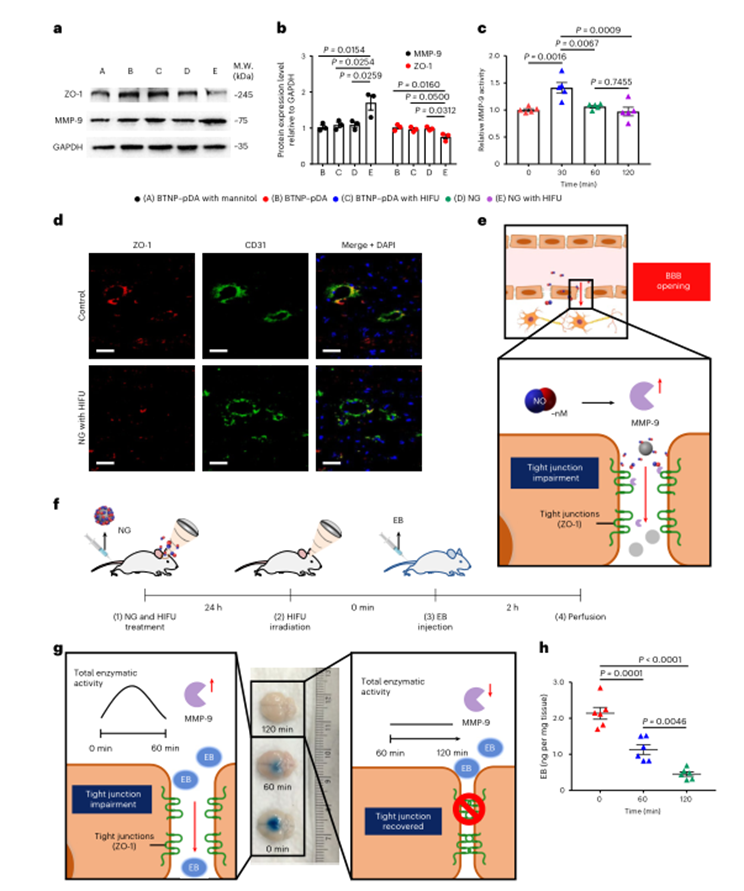
图5 NO通过破坏紧密连接激活血脑屏障打开
STN是FDA批准的DBS靶点,它能够传出投射到多巴胺能神经元所在的SNc中,促进神经元主动释放多巴胺。旋转棒测试用于评估MPTP处理后不同治疗组小鼠的运动协调性,并记录它们的掉棒潜伏期以评估运动功能。纳米颗粒和多次HIFU处理的小鼠掉棒潜伏时间显著延长,并在第十六天的旷场实验中体现出更频繁的自主运动,表明了小鼠运动功能的逐渐改善。为了探究超声介导的压电刺激对STN细胞的实际激活作用,在第16天通过免疫标记STN区域c-Fos水平,并进行了定量评估。纳米粒子和多次HIFU刺激治疗组显示出了STN区c-Fos+细胞显著增多。这些结果表明,在帕金森病模型中,超声驱动纳米颗粒产生的DBS能够激活STN区域,增强运动功能。
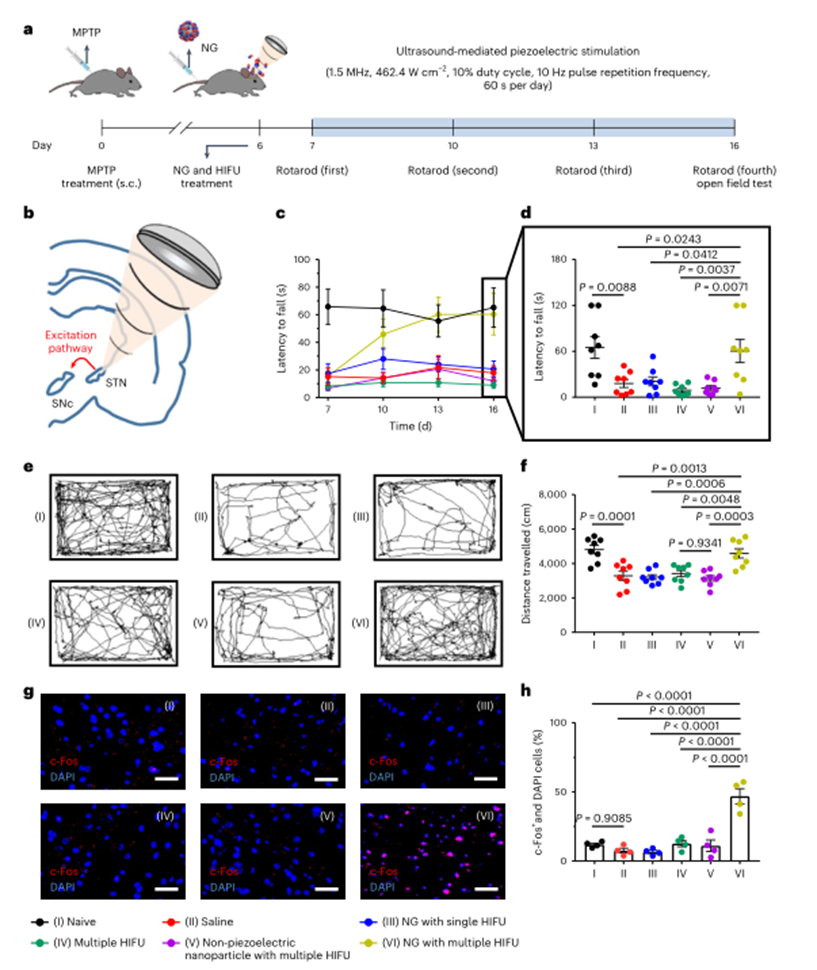
图6 体内脑深部刺激
已有早期证据表明,STN-DBS通过减轻神经细胞死亡来保护多巴胺能神经元,限制神经退行性疾病中的突触功能障碍,从而减缓疾病的进展。通过恐惧记忆回忆测试评估了超声介导对STN的压电刺激的神经保护作用。观察到MPTP处理的对照组在恐惧习得方面没有差异,而仅在使用纳米颗粒和多次HIFU治疗的小鼠中才能观察到恐惧记忆唤起时恐惧水平的增强,而其他对照组没有显著差异。TH水平的降低反映了黑质纹状体通路中多巴胺能神经元的退化,MPTP处理组小鼠SNc区域TH+神经元数量明显减少。然而,在接受HIFU辅助纳米颗粒治疗的小鼠中,观察到更多的TH+神经元。这些结果表明,压电刺激通过抑制多巴胺能神经元的变性而导致多巴胺的释放,从而减轻帕金森病的症状。
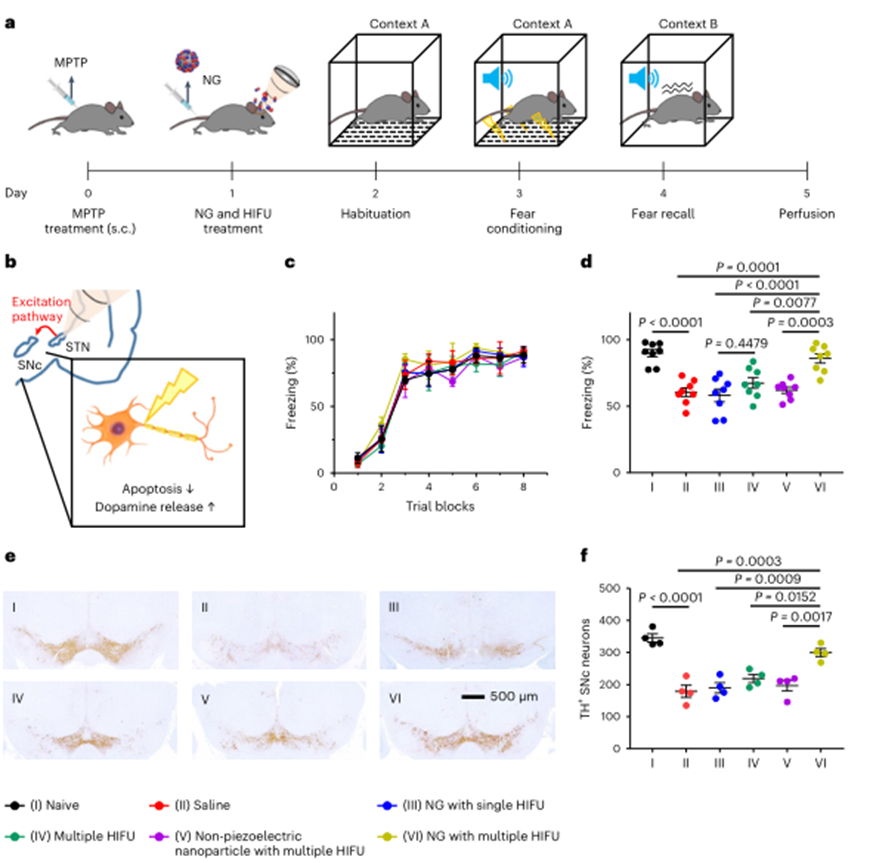
图7 体内DBS神经保护
在H&E组织学分析中,纳米颗粒和HIFU联合处理后的脑组织以及其他主要器官组织,包括心、肝、肺、脾和肾中未观察到明显的形态差异。治疗后也没有检测到任何与炎症相关的脾增大、肝酶活性升高或显著的体重减轻。这些结果表明,HIFU和纳米颗粒的联合治疗没有引起任何局部和全身毒性。并且在注射后60天,每个组织中积累的纳米颗粒数量显著减少,表明了纳米颗粒在体内有得到足够的清除。
该研究为神经退行性疾病的脑深部刺激疗法提供了一种无线、非侵入性的策略。

图8 纳米颗粒的体内安全性
参考文献:E. Faggiani, A. Benazzouz, Deep brain stimulation of the subthalamic nucleus in Parkinson’s disease: From history to the interaction with the monoaminergic systems. Progress in Neurobiology, 2017, 151, 139-156. https://doi.org/10.1016/j.pneurobio.2016.07.003